Kemi
pH
Der fremstilles en vandig opløsning af phosphorsyre med koncentrationen 0,045 M.
- Beregn pH i phosphorsyreopløsningen ved 25 grader C, idet phosphorsyre kan opfattes som en monohydron syre.
Jeg har udregnet ![[H_3O^+]](https://media.studieportalen.dk/images/equations/giL_gZLikroJ05ADGEbV0w==.gif) ved brug af formlen:
ved brug af formlen: 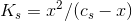 . Herefter har jeg udregnet pH ved brug af formlen:
. Herefter har jeg udregnet pH ved brug af formlen:
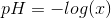
Skal jeg bruge informationen om monohydron syre til noget i denne opgave?
Svar #5
31. maj 2016 af mathon
styrkeopdeling
stærk syre 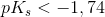
stærk base 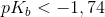
middelstærk syre 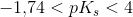
middelstærk base 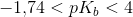
svag syre 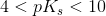
svag base 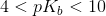
meget svag syre 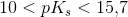
meget svag base 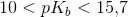
yderst svag syre 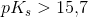
yderst svag base 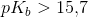
Svar #6
31. maj 2016 af sarah0010 (Slettet)
Men hvorfor er det så relevant, at jeg her får at vide, at den er monohydron?
Jeg bruger jo pKs-værdien for 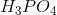 . Den er da ikke monohydron.
. Den er da ikke monohydron.
Skriv et svar til: pH
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


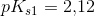
![\frac{\left [ H_3O^+ \right ]^2}{0{,}045-\left [ H_3O^+ \right ]}=10^{-2{,}12}\; \; \; \; \; \; \; \; 0<\left [ H_3O^+ \right ]<0{,}045](https://media.studieportalen.dk/images/equations/iDyZaVT3bQTojXg7lCYBoA==.gif)
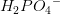 0,2 % dissocieret, hvorfor dens indflydelse på
0,2 % dissocieret, hvorfor dens indflydelse på ![\left [ H_3O^+ \right ]](https://media.studieportalen.dk/images/equations/6Fj_WtmFzG5dmkgoP0Rfkg==.gif) ikke er nævneværdig.
ikke er nævneværdig.