Kemi
KEMI EKSAMEN HTX 31 MAJ 2016
Hej SP'er
Er der nogle, der har været op til eksamen i kemi idag og evt. vil ligge deres facit op således, at jeg kan sammenligne med mige egne resultater?
Svar #1
31. maj 2016 af Skaljeglavedinelektier
Konkrete spørgsmål vil jeg gerne hjælpe med - jeg har dog ikke sættet eller har lavet det.
Svar #2
31. maj 2016 af hejhejhje (Slettet)
Jeg havde et spg., hvor man skulle vise, at ligvægtskonstanten var 1,74 men det fik jeg slet ikke selvom jeg prøvede alt muligt... Vedhægter lige opgaveteksten + spørgsmålet. I bilaget blevet det yder oplyst, at enthalip var:
33,2 NO2
11,1 N2O4
Entropi var:
304,4 N2O4
240,1 No2
I en tidligere opgave blev enthalpitilvæksten beregnet til 55,3 kJ/mol
Svar #3
31. maj 2016 af hejhejhje (Slettet)
Vedhæfter også lige det andet udklip
Svar #4
31. maj 2016 af Skaljeglavedinelektier
Brug først formlen: 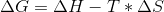 - husk at entalpi er i kJ, og entropi er i J. Du skal enten dividere eller gange med 1000 alt efter, hvilken du vælger at gøre noget ved.
- husk at entalpi er i kJ, og entropi er i J. Du skal enten dividere eller gange med 1000 alt efter, hvilken du vælger at gøre noget ved.
Brug så formlen: 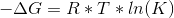 - isoler K, men sørg for at gaskonstanten passer hertil.
- isoler K, men sørg for at gaskonstanten passer hertil.
Argumentation for at det skal være bar: 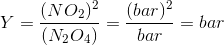
Svar #5
31. maj 2016 af hejhejhje (Slettet)
Ja, det har jeg prøvet men for ikke 1,74, men istedet 1,52*10^9 og der er mange fra min klasse, der oplevede det samme...
Så er der evt. en anden måe dette kan beregnes på?
Svar #12
31. maj 2016 af hejhejhje (Slettet)
#9 - Er der mulighed for at du ville lægge dine andre facit op?
Svar #13
31. maj 2016 af mariaasam (Slettet)
Så lidt. Jeg har ikke været oppe endnu, skal først op torsdag :-)
Svar #18
01. juni 2016 af haugf (Slettet)
Alternativt kan du få samme resultat ved Van Hoffs ligning
Skriv et svar til: KEMI EKSAMEN HTX 31 MAJ 2016
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.






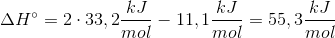
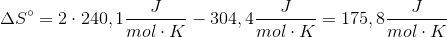
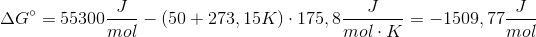
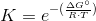
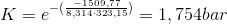 (#4 har forklaret enhed)
(#4 har forklaret enhed)