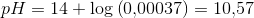Kemi
pH for blanding af HNCO og NaOH
Facit (pH = 10.57)
Jeg har i forrige opgave udregnet kA = 3.44 * 10^-4.
Nogen som kan hjælpe? Jeg har brugt pufferligning men får overhovedet ikke det rigtige resultat.
Svar #1
10. juni 2016 af umolich
Hvilke stofmængder har du sat ind i pufferligningen, og hvordan er du kommet frem til dem?
Tilføjelse: Er du sikker på de mængder og koncentrationer du har skrevet? Umiddelbart får jeg at der er tilsat overskud af NaOH, hvorfor pH burde blive bestemt af overskudet.
Svar #3
10. juni 2016 af SomethingDarkside
Svar #4
10. juni 2016 af SomethingDarkside
Skriv et svar til: pH for blanding af HNCO og NaOH
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




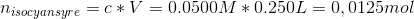
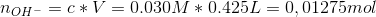
![\left [ OH^- \right ]=\frac{0{,}00025\; mol}{(250+425)\cdot 10^{-3}\; L}=0{,}00037\; M](https://media.studieportalen.dk/images/equations/tZN3w6PDXrMH46-DTiKC-A==.gif)
![pH=14+\log\left(\left [ OH^- \right ]\right)](https://media.studieportalen.dk/images/equations/Iw40ofQQ4guAUbisrXivVw==.gif)