Kemi
Beregn ΔH° og ΔG° for denne reaktion ved en temperatur på 25°C.
I finder min besvarelse finder i nederst. Opgaven lyder på følgende:
I medierne nævnes det ofte at H2 kan anvendes som et ”forureningsfrit” brændstof til f.eks. biler. En mulig måde at fremstille H2 på, er at omdanne træ ved reaktion med vand. Træ indeholder store mængder af lignin, der er polymer af phenoler (C6H5OH).
ΔH°f (C6H5OH(s)) = −165 kJ/mol
ΔG°f (C6H5OH(s)) = −50 kJ/mol
Betragt følgende reaktion: C6H5OH(s) + 11 H2O(g) → 14 H2(g) + 6 CO2(g)
a) Beregn ΔH° og ΔG° for denne reaktion ved en temperatur på 25C.
~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~
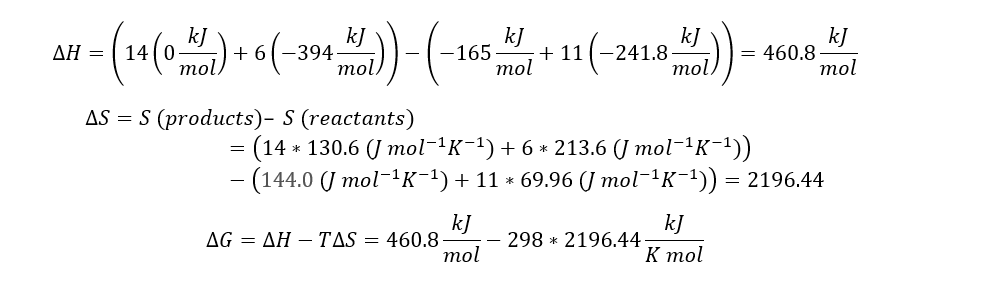
Svar #3
10. juli 2016 af feynman (Slettet)
Du mener kJ/(K mol)?
Kan du se uden videre om første opgave er korrekt beregnet?
Svar #5
10. juli 2016 af feynman (Slettet)
Ja, selvfølgelig. Kelvin går ud med Kelvin, jvf. dimensionel analyse.
Er mit svar korrekt numerisk set?
Skriv et svar til: Beregn ΔH° og ΔG° for denne reaktion ved en temperatur på 25°C.
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.









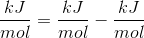
![\left [T \Delta S^\Theta \right ]=K\cdot \frac{kJ}{mol\cdot K}=\frac{kJ}{mol}](https://media.studieportalen.dk/images/equations/ap6sbbkVOu74pe8bzy8lvQ==.gif)