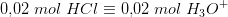Kemi
Hvad bliver pH efter blanding af NaOH og HCl
Hej!
Jeg er lidt rusten i pH-udregninger.
Jeg har problemer med at finde svar på følgende....
Hvis jeg hælder 2 L NaOH (som indeholder 48 mg/L) i 0,2 L HCL med concentrationen 0,1 M, hvad ender pH så med at være?
På forhånd tak :)
Svar #1
13. juli 2016 af mathon
NaOH:
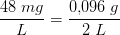
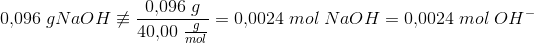
da NaOH er letopløselig i vand.
HCl:
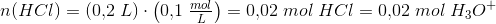
da HCl er letopløselig i vand.
Efter neutralisationen er
overskuddet af H3O+:
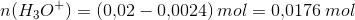
Blandingskoncentrationen
af H3O+:
![[H_3O^+]=\tfrac{0{,}0176\; mol}{2{,}2\; L}=0{,}008\; M](https://media.studieportalen.dk/images/equations/1anUyTDdG-tbyDaKAYVhuA==.gif)
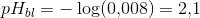
Svar #3
13. juli 2016 af mettekbh (Slettet)
Det er fantastisk! Stor stor hjælp! Jeg takker mange gange!
Skriv et svar til: Hvad bliver pH efter blanding af NaOH og HCl
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.