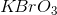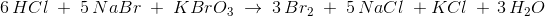Kemi
Redoxreaktion mellem Natriumbromid og Kaliumbromat.
Hej jeg har forvirret mig selv.
I basis kemi B står der at en redoxreaktionen mellem bromid (Br–) og bromat (BrO3–) i sur opløsning foregår således:
H{+} + Br{-} + BrO3{-} = Br2 + H2O
AFSTEMT
6 H{+} + 5 Br{-} + BrO3{-} = 3 Br2 + 3 H2O
Man kan demonstrere reaktionen ved fx at opløse 0,100 mol NaBr og 0,00100 mol KBrO3 i 900 mL vand i et stort bægerglas, hvorefter reaktionen startes ved tilsætning af 100 mL 2? HCl. Samtidig startes et stopur.
Mit spørgsmål er:
Hvis nu at jeg vælger at se på hele reaktionen vil det så se således ud?
HCl + NaBr + KBrO3 = Br2 + H2O + Na{+} + K{+} +Cl{-}
AFSTEMT
6 HCl + 5 NaBr + KBrO3 = 3 Br2 + 3 H2O + 5 Na{+} + K{+} + 6 Cl{-}
Er der nogen der kan vise mig hvordan denne ligning er blevet afstemt.
Det er ikke hjemme arbejde. Jeg kender godt til redoxreaktions afstemningsreglerne men jeg har brug for, at nogen viser mig det med det, med det her eksempel.
På forhånd tak for hjælpen.
Svar #2
14. juli 2016 af mathon
 disproportioneres/dismuteres
disproportioneres/dismuteres
hvorfor begyndelsesnotering
anbefales som:
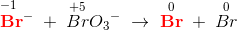
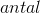
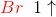
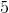
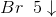
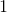
afstemning af op-/nedgange:
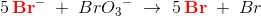
dvs
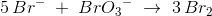
afstemning af ladning:
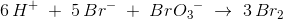
afstemning af hydrogen:
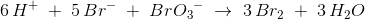
oxygen stemmer.
Svar #3
14. juli 2016 af Fatima786
Tak mathon,
Det ser ud til at det er selve afstemning som jeg ikke forstår. Altså inden man nå til at tælle ladningerne og finde ud af hvormange H+ ioner man skal ligge til og tilsvarende vand. Ser reaktion så sådan ud før det:
Br{-} + BrO3{-} = Br2
Ladning:
Br{-}= -1
BrO3{-}= Br 5+, O 2-
Br2= 0
Nu skal jeg se på
oxidation fra Br{-}= -1 til Br2= 0 dvs. +1
reduktion fra Br 5+ til Br2= 0 dvs. -5
5 Br{-} + 1 BrO3{-} = 5 Br2
men det passer jo ikke... hvad gør jeg forkert??
Skriv et svar til: Redoxreaktion mellem Natriumbromid og Kaliumbromat.
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




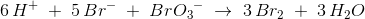
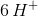 matcher
matcher 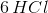
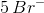 matcher
matcher 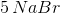
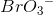 matcher
matcher