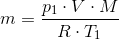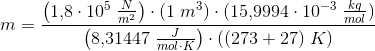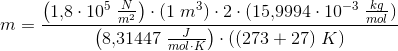Fysik
En gas' masse
Hej, jeg har en opgave, hvor jeg skal finde gasmassen, men sidder desværre fast.
Jeg har flg. data til rådighed: temperatur før/efter opvarmning: 27 C og 420 C. Trykket: 1.8 10^5 Pa. Gassens varmekapacitet ved konstant volumen: 0.665 kJ. Volumen: 1 m^3.
Gassen er desuden dioxygen, og jeg har fundet dens atommasse til 15,9994.
Nogen, der kan hjælpe?
Svar #2
25. juli 2016 af microphone (Slettet)
Hov, den smuttede lige. Volumen er konstant, trykket er ikke
EDIT: Det er forresten trykkket for den første temperatur, jeg har
Svar #4
25. juli 2016 af microphone (Slettet)
Tak for hjælpen, men det har jeg prøvet, hvilekt giver mig 1,15.
Ifølge facitlisten skal gassens masse være 2,13 kg...
EDIT: eller hov, det er rigtigt! Havde også selv glemt at gange 2 på atommassen ligesom dig :)
Skriv et svar til: En gas' masse
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.