Kemi
Redoxreaktioner
Jeg har nu oprettet en ny tråd som forsættelse på den anden tråd : https://www.studieportalen.dk/forums/thread.aspx?id=1694139&page=2
I forhold til svar # 29 , er H altid + 1 og S -2? så OT er altså -1.
Er reduktionen så fra 6 ned til 1 , altså 5. ??SO-2???4 ?OT 6, og H2?S 1 .. Jeg håber jeg har forstået det rigtigt nu
Svar #1
29. juli 2016 af Skaljeglavedinelektier
Du tager det stadigvæk for hele stoffet. Man kigger kun på det enkelte atom. OT for S er altså -2 i H2S.
Normalt har H (hydrogen) OT +,1 mens O (oxygen) normalt har OT -2. Dette gælder dog ikke altid, hvilket ses ved peroxider f.eks.
Spørgsmålstegnene er meget forvirrende i teksten, så jeg ved ikke helt, hvad du mener i den sammenhæng.
Svar #2
29. juli 2016 af HFNU (Slettet)
Ja ok tak, det jeg prøver at forstå er hvorfor H er -2 i H2S . Hydrogen har jo OT + 1, er H2?O så en perioxid??
Det jeg skriver i mit indlæg først er ladningen jeg prøver at finde, men det er jo lidt svært da jeg ikke har lært det med OT endnu
Svar #3
29. juli 2016 af Skaljeglavedinelektier
H har ikke OT -2 i H2S. Hvert hydrogen atom har OT +1, hvilket sammenlagt giver +2 for de to hydrogenatomer, da 1+1 = +2. Ud fra grundreglen, se det nedenstående, giver det S i H2S OT -2. Ladningen af H2S er 0. Du skal blot løse ligningen: 2 + x = 0.
Grundregel: For en vilkårlig partikel er summen af de indgående atomers oxidationstal lig med partiklens ladning
Reduktion/oxidation handler ikke om ladning, hvilket dit spørgsmål i #0 indikerer.
H2O er ikke en peroxid. Den simpleste peroxid er H2O2.
Svar #4
29. juli 2016 af HFNU (Slettet)
Nej det er rigtigt nok, jeg ved godt det ikke handler om ladning, men jeg skal også både finde ladningen for selve reaktionen, og OT for at kunne afstemme reaktionen med en reduktion og oxidation.
Ja det må du undskylde jeg fandt ud af at det var S i H2?O du skrev var -2.
Men er OT for H2?S ikke bare -2 så?
ladningen for oxidationen må så være 2.
Men jeg er ikke helt sikker på reduktionen... er det fra 6 ned til 2?. Mange tak igen for hjælpen
Svar #5
29. juli 2016 af Skaljeglavedinelektier
Du roder lidt rundt i begreberne. Oxidationstal er en slags "fiktive" ladninger og angiver altså ikke den reelle ladning.
Man kigger stadigvæk kun på de enkelte atomer ved oxidationstal og ikke på hele molekylet.
Prøv at skrive din reaktion ind og så prøver jeg at hjælpe dig med at løse den.
Svar #6
30. juli 2016 af HFNU (Slettet)
Ja ok ...det jeg mente var bare at jeg jo skal finde OT før jeg kan bestemme ladningen for reaktanterne og produktet.
Reaktionen er : Zn + SO-2???4 → Zn?+2 + H2?S
Jeg har prøvet at finde OT for de enkelte atomer. De skriver jeg lige ned også så kan du måske bedre hjælpe mig videre.
OT for Zn :0
OT for S : 6 ?
OT for Zn?+2 ???: + 2
?OT for H?2?S : - 2 ?
Svar #7
30. juli 2016 af Skaljeglavedinelektier
Du misforstår stadig nogle ting. Det ville også hjælpe, hvis du fjernede de spørgsmålstegn.
Reaktionen er således: Zn + SO42- ----> Zn2+ + H2S
OT for Zn (reaktantside): 0
OT for Zn (produktside): +2
OT for S (reaktantside): +6
OT for S (produktside): -2
Næste skridt - der ganges på kryds - tallene efter pilene føres op som koefficienter:
Oxidation: Zn 2 ↑ · 8
Reduktion: S 8 ↓ · 2
8 Zn + 2 SO42- ----> 8 Zn2+ + 2 H2S
Næste skridt - ladningen på hver side findes.
Ladning reaktanside: 2 * (-2) = - 4
Ladningen produktside: 8 * (+2) = + 16
Forskel på + 20. Dette løses ved at tilføre 20 H+ på reaktantsiden:
8 Zn + 2 SO42- + 20 H+ ----> 8 Zn2+ + 2 H2S
Næste skridt - Antallet af hydrogenatomer og oxygenatomer på hver side findes.
Antal på reaktantsiden: Der er 20 H og 8 O.
Antal på produktsiden: Der er 4 H og 0 O.
Der mangler så at sige 16 H og 8 O på produktsiden. Dette løses ved at afstemme med vand. 16 H og 8 O svarer til 8 vandmolekyler (H2O). Den endelig løsning er derfor:
8 Zn + 2 SO42- + 20 H+ ----> 8 Zn2+ + 2 H2S + 8 H2O
Svar #8
30. juli 2016 af HFNU (Slettet)
Ja jeg har stadig lidt svært ved det. Det med spørgsmålstegnene, skal nok huske ikke at sætte så mange kan godt se det er forvirrende.
Jeg er bare ikke helt med endnu . I forhold til fald. Hvordan kan det være det er 8 ?
Er OT ikke + 6 på reaktantsiden og - 2 på produktet siden, hvordan kan det så give 8 i fald
Svar #9
30. juli 2016 af HFNU (Slettet)
Hvis du vil hjælpe med at forstå ladningen også for reaktantsiden og produktsiden.
Hvilke to stoffer gange du sammen: 2•? 2 = - 4
Produktsiden 8 • 2 = 16.
Siger du stigning gange med stigning, og fald gange stigning for at finde ladningen? Jeg er lidt forvirret
Svar #10
30. juli 2016 af mathon
Oxidation: Zn 2 ↑ · 4
Reduktion: S 8 ↓ · 1
afstemning af op- og nedgange:
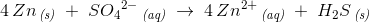
afstemning af ladning:
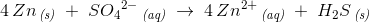
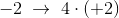
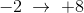
Der tilføred 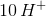 på reaktantsiden:
på reaktantsiden:
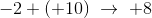
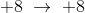
hvoraf:
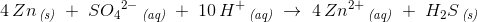
afstemning af hydrogen:
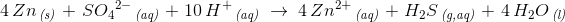
oxygen stemmer.
Svar #11
30. juli 2016 af mathon
i #19 og #20 i
https://www.studieportalen.dk/forums/thread.aspx?id=1694139
tog jeg fejl.
 i
i  oxideres jo ikke men reduceres tværtimod.
oxideres jo ikke men reduceres tværtimod.
Svar #12
30. juli 2016 af mathon
#10
er i overen(s)stemmelse med #7
8 Zn + 2 SO42- + 20 H+ ----> 8 Zn2+ + 2 H2S + 8 H2O divideret igennem med 2.
Svar #13
30. juli 2016 af Skaljeglavedinelektier
Ja jeg beklager, at jeg ikke lige fik divideret med 2. Metoden er dog rigtig.
Svar #14
30. juli 2016 af HFNU (Slettet)
Jeg har virkelig kigget grundigt på svarene , og jeg har stadig svært ved at forstå reduktionen. S er på reaktantsiden + 6 til at starte med korrekt? S falder så ned til 2 på produktsiden er det korrekt? Hvis det er så kan jeg ikke helt forstå hvordan det giver 8 i fald. Måske kan en af jer forklarer mig hvordan det helt præcis bliver et fald på 8.
I svar #10 kan jeg så se at du tager Oxidation for Zn : 2 og • 8 ( Hvorfor gør du det, er det fordi der er et fald på 8) ?
Du tager også reduktionen af S og • 1 ( hvorfor skal S ganges med 1 ) ?
Mange 1000 tak
Svar #16
30. juli 2016 af HFNU (Slettet)
Ja det er nemlig reduktionen af S jeg mener , men hvordan giver + 6 -2 = 8 er det mig som ikke forstår simpelt regning?
Svar #19
30. juli 2016 af Skaljeglavedinelektier
OT for S på reaktantsiden er +6 (plus 6). OT for S på produktsiden er -2 (minus 2). Forskellen mellem 6 og -2 er 8.
Zn har derimod OT 0 på reaktantsiden og OT +2 (plus 2) på produktsiden. Forskellen mellem 0 og 2 er 2.



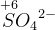 reduceres til
reduceres til 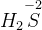
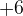 til
til 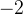 er
er 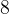 trin ned pr atom OT regnes med fortegn.
trin ned pr atom OT regnes med fortegn.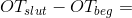
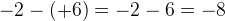 altså
altså