Kemi
Flervalente syre og amfolytter
Jeg vil meget gerne hører om der er nogle der vil hjælpe mig videre med den opgave jeg vedhæfter i denne tråd.
Jeg mangler at skrive om de 2 trin og svarer på det sidste spørgsmål.
På forhånd mange mange tak
Svar #5
27. august 2016 af HFNU (Slettet)
Dette er flere opgaver , ca 6 sider, men det er kun opgaven omkring phosphorsyre jeg gern vil have hjælp til.
Opgave 4.4 hedder den
Svar #6
27. august 2016 af Skaljeglavedinelektier
a) Opskriv reaktionsskemaerne for de tre trin i hydronafgivelsen
I dokumentet står der:
I 1. trin er det korresponderende syre-basepar for phosphorsyren og vand : Dihydrogenphosphat og oxoniumion.
I 2. trin er det korresponderende syre til
Er det noget, der skal udfyldes, eller mangler der bare noget i dokumentet, jeg ikke kan se?
b) Hvilke af stofferne i phosphorsyresystemet er amfolytter:
Dihydrogenphosphat (H2PO4-) og hydrogenphosphat (HPO42-) er begge amfolytter. Vand er også en amfolyt, men optræder ikke som en i disse reaktioner.
Reaktionerne er ikke skrevet så flot op i dokumentet. Du kan med fordel bruge WordMat.
Svar #7
27. august 2016 af mathon
1. trin
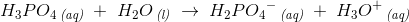
2. trin
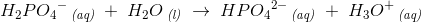
3. trin
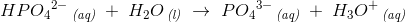
I 1. trin er
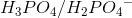 korresponderende syre-basepar
korresponderende syre-basepar
I 2. trin er
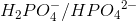 korresponderende syre-basepar
korresponderende syre-basepar
I 3. trin er
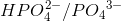 korresponderende syre-basepar
korresponderende syre-basepar
.
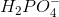 og
og 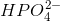 er amfolytter
er amfolytter
Svar #8
27. august 2016 af HFNU (Slettet)
1000 tak for hjælp jeg har skrevet at :
I 1 .trin har jeg skrevet at det : Dihydrogenphosphat og oxoniumion? H?2PO4 og H3?O?+ der er korresponderende syre basepar jeg kan se at mathon at du har skrevet , at du har et andet stof med H?3PO?4 ?
?Er der en af jer der evt kan hjælpe mig med hvad stofferne hedder i de 3 trin. Jeg kender lidt til navngivning af stofferne, men jeg er meget i tvivl omkring de her.
Svar #9
27. august 2016 af HFNU (Slettet)
Skaljeglavedinelektier du har ret , jeg synes heller ikke selv det er pænt skrevet op, og jeg mangler også en masse værktøjer, problemet er bare at eg simpelthen ikke kan downloade WordMat. Jeg ved faktisk slet ikke hvad der er problemet, når jeg prøver
Svar #10
27. august 2016 af Skaljeglavedinelektier
H3PO4 hedder phosphorsyre.
H2PO4- hedder dihydrogenphosphat(ion).
HPO42- hedder hydrogenphosphat(ion).
PO43- hedder phosphat(ion).
WordMat er ellers et utrolig godt program.
Svar #11
27. august 2016 af HFNU (Slettet)
Ja jeg tror jeg skal prøve at spørger min lærer omkring det måske
TAK Skaljeglavedinelektier for svar på stoffernes navne. Ved du evt om jeg har den første trin i reaktionen forkert, altså det jeg skriver i svar #8.
1. trin er det korresponderende syre basepar ikke : Dihydrogenphosphation og oxoniumion??.
Svar #12
27. august 2016 af Skaljeglavedinelektier
H3PO4 og H2PO4- er et korresponderende syre-basepar.
H2O og H3O+ er egenligt også et korresponderende syre-basepar, men næppe relevant for opgaven.
Ved afgivelse eller optagelse af en hydron skal syren og basen kunne omdannes til hinanden.
Svar #13
27. august 2016 af HFNU (Slettet)
Tak igen .....
Jeg har kigget flere gange på det hele, jeg forstår pludselig ingenting. Jeg ved ikke hvilke stoffer der reagerer som syrer og hvilke som base...
Har du mulighed for at hjælpe med at uddybbe hvad der sker i de forskellige 3 trin?
Svar #14
28. august 2016 af mathon
#13
Tag udgangspunkt i Brøndsteds syredefinition:
En vandfortyndet syre er et molekyle, der kan fraspalte mindst én 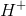
En vandfortyndet base er et molekyle, der kan optage mindst én 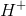
Det, der bliver til rest, når syren har fraspaltet en 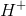 , er naturligvis en base, da syrerestionen under optimale omstændigheder kan genoptage en
, er naturligvis en base, da syrerestionen under optimale omstændigheder kan genoptage en 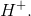
For polyvalente syrer er der flere trin:
f.eks.
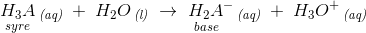
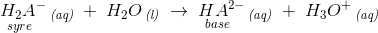
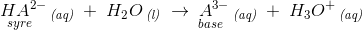
hvoraf de korresponderende syre-basepar fremgår.
Endvidere ses det, at
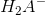 og
og 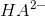 både kan reagere som syre og som base.
både kan reagere som syre og som base.
Sådanne ioner kaldes amfolytter.
Hertil kommer styrkeforholdene, som udelades i denne korte fremstilling, hvis hovedformål er at skabe begrebsklarhed.
Svar #15
28. august 2016 af HFNU (Slettet)
Undskyld mathon dit svar #14 er jeg desværre ikke med på .. :( f.eks det H?3A, H?2A?- og HA?2- i de forskellige 3 trin er, altså hvad hvad A står for her?. Jeg kan godt forstå det du skriver med hvilke af stofferne som er syre og dem som er base heldigvis
I forhold til dit svar i #7.
I . trin 1: Skriver du at det korresporresponderende syre basepar : Som phosphorsyre og dihydrogenphosphation.
( Jeg havde forstået det som om at det var dihydrogenphosphat og oxoniumion,H3?O+??) Det er helt forkert går jeg udefra.
Er det så H3?PO4?( syre) som afgiver en H??+ og H2PO?4?-(?(base) som modtager H+ ionen og bliver en base??? Det er lidt modsat det jeg har forstået indtil nu (udefra svar# 14) så ser det ud som om det de to stoffer jeg har understreget som er syre og henholdsvis base?
Svar #16
28. august 2016 af Skaljeglavedinelektier
Du skal ikke tænke så meget over, at der står A. Bare tænk dig til, at der står de samme stoffer som i #7.
For et korresponderende syre-basepar skal der gælde det følgende: Ved afgivelse eller optagelse af en hydron skal syren og basen kunne omdannes til hinanden.
Det gælder f.eks. for H3PO4 og H2PO4- i trin 1. H3PO4 afgiver en hydron til vand og omdannes til H2PO4-. Ifølge Brønsted–Lowry teorien gør det H3PO4 til en syre. Hvis du vendte pilen om, i reaktionen i trin 1, ville H2PO4- optage en hydron fra H3O+ og omdannes til H3PO4. Ifølge Brønsted–Lowry teorien gør det H2PO4- til en base. De to stoffer, H3PO4 og H2PO4-, kan altså omdannes til hinanden ved enten at afgive eller optage en hydron.
H2PO4- agerer som en base i trin 1, da den kan optage en hydron. I trin 2 optræder stoffet dog som en syre, da den kan afgive en hydron. Det gør altså H2PO4- til en amfolyt. Det samme gælder for HPO42-.
H2O og H3O+ er også et korresponderende syre-basepar, ligesom H2O og OH- også er, da dette par også opfylder betingelserne. Dette par er dog sandsynligvis ikke det interessante for dig i opgaven her.
Svar #17
28. august 2016 af HFNU (Slettet)
Mange mange 1000 tak skaljeglavedinelektier.
Er det ok jeg spørger lidt ind til trin 2, H2PO?4??- optræder som en syre da den kan afgive en H+, men hvilket stof afgiver den en hydron til? Er det til H2?O (vand) igen og bliver omdannet til H2PO4?-2?.
Det er lige for at forstå det du siger med at syren og basen skal kunne omdannes til hinanden.
Svar #18
28. august 2016 af HFNU (Slettet)
Undskyld alle spørgsmålstegnene, håbe du stadig kan se hvad jeg har skrevet
Svar #19
28. august 2016 af Skaljeglavedinelektier
Det er kun indenfor det korresponderende syre-basepar, at de skal kunne omdannes til hinanden ved optagelse eller afgivelse af en hydron. Hvis du vender pilene i hver reaktion, vil parrene omdannes til hinanden ved den modsatte proces - afgivelse ændres til optagelse af en hydron.
H2PO4- afgiver en hydron til H2O.
H2PO4- afgiver en hydron og bliver til HPO42-. Der er en H+ i forskel mellem disse to stoffer.
H2O optager en hydron og bliver til H3O+. Der er en H+ i forskel mellem disse to stoffer.
Svar #20
28. august 2016 af HFNU (Slettet)
Ok jeg er lidt mere med nu. Tak
Jeg vil også lige spørger til trin 3, kan man så sige HPO4?-2? afgiver en Hydron og bliver omdannet til PO4?3?



