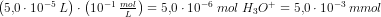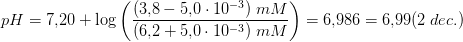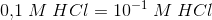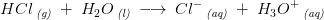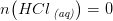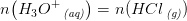Kemi
Side 2 - pH
Svar #21
13. september 2016 af mathon
I 5) kender vi ikke de resulterende koncentrationer uden først at skulle beregne tilbageværende antal mol.
Svar #23
10. februar 2017 af mieeeeeee (Slettet)
#83)
fra 1)
1 dråbeindeholder
efter tilsætning:
Du finder ud af, at 1 dråbe er 5*10_5 L; men hvorfor ganger du det med 10-1 mol/L?
Svar #26
10. februar 2017 af mieeeeeee (Slettet)
Tak for hurtigt svar :) Du får et resultatet, der er 5.0*10-6 mol, men pludselig har du et resultat for H30+. Hvordan kommer du dertil? Undskyld jeg spørger så meget, men der er lidt tid siden jeg har haft kemi.
Svar #28
11. februar 2017 af leilaa12 (Slettet)
#27#26
HCl er en stærk syre og er derfor 100% protolyseret
Ok, tak Mathon, du er virkelig en hjælp :)
Har kun et spørgsmål mere - når du så udregner pH skriver du : pH = 7.21+log(3.8 - (5.0*10-3)/(6.2+(5.0*10-3))
Hvorfor skriver du + og - inde i parenteserne? Hvorfor er det ikke gange?
Svar #29
11. februar 2017 af mathon
#28
Bjarne giver x kr til Christian.
Bjarne får x kr mindre men ikke x gange mindre.
Christian får x kr mere men ikke x gange mere.
Svar #30
11. februar 2017 af leilaa12 (Slettet)
#94)
forholdetændres ikke hvorfor
ikke ændres.
hvorfor ændres forholdet ikke? er det ikke noget med, at hvis man fortynder en stærk base eller syre 10 gange, falder pH med 1? Men jeg ved, at H2PO4- er en meget svag syre.. hvad er så gældende? Intet sker?
Svar #32
12. februar 2017 af madslægen (Slettet)
#31kan nogen svare mig? :)
Godt spørgsmål, er også selv i tvivl. Nogen der vil give en hjælpende hånd?
Svar #33
12. februar 2017 af mathon
Nu er citatet revet ud af sin sammenhæng fra #4,
hvor fortyndingen er fælles for ![\left [ B \right ]](https://media.studieportalen.dk/images/equations/wqRBlKL1VGI-WgKCf8K9YA==.gif) og
og ![\left [ S \right ]](https://media.studieportalen.dk/images/equations/RNhp6iJRHCDyosvRDX5O6Q==.gif)
så
![\frac{ \left [ B \right ]_{f\! ort}}{ \left [ S \right ]_{f\! ort}}=\frac{k\cdot \left [ B \right ]}{k\cdot \left [ S \right ]}=\frac{ \left [ B \right ]}{ \left [ S \right ]}](https://media.studieportalen.dk/images/equations/Wfyl9W7zEReRlEic4mtgUg==.gif)
Svar #34
12. februar 2017 af mathon
Hvis forholdet
![\frac{\left [ B \right ]}{\left [ S \right ]}=\frac{n_B}{n_S}](https://media.studieportalen.dk/images/equations/BgO7A06NSK9tgDPkZJE49Q==.gif) da volumenet er fælles.
da volumenet er fælles.
For en fortyndet, monohydron, svag syre:
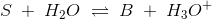
ligevægtskonc. cs(1-α) cs·α cs·α 0 < α < 1
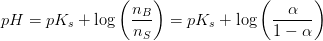
Svar #35
12. februar 2017 af mathon
Hvis pufferen har en rimelig kapacitet ændres 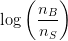 ikke meget selv ved tilsætning af et mindre volumen
ikke meget selv ved tilsætning af et mindre volumen
stærk syre eller stærk base,
hvilket ligger i:
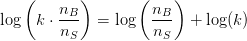
blot
![k\in\left [ 0{.}89\; ;\; 1{.}12 \right ]](https://media.studieportalen.dk/images/equations/Sq7A8yb-QX1HgNSs9MH-_A==.gif) da
da 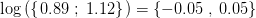 .
.
Måles pH kun med 1 dec. mærkes pH-ændringen næsten ikke selv om 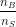 ændres
ændres 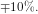
Svar #36
13. februar 2017 af VIOR (Slettet)
I opg. 5 bliver koncentrationerne af 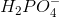 og
og 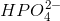 ganget med 100 mL. Hvorfor det?
ganget med 100 mL. Hvorfor det?
Skriv et svar til: pH
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.