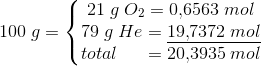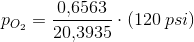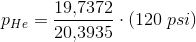Kemi
Partialtryk
21. september 2016 af
pige5
-
Niveau: A-niveau
Hej, jeg har problemer med en lille opgave. Den lyder på følgende:
Dykkere, der lider af dykkersyge, behandles i trykkamre ved hjælp af heliox (21 % oxygen, 79 % helium) ved tryk på op til 120 psi. Beregn partialtrykket af O2 i et trykkammer under disse forhold.
Jeg ved, jeg skal anvende Dalton's lov, men jeg ved ikke hvordan. Nogen som kan hjælpe? :)
Skriv et svar til: Partialtryk
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.