Kemi
Omregning af cal/mol til J/g
Jeg har en opgave, hvor jeg virkelig ikke aner, hvordan jeg skal gå i gang med den. Den lyder således:
For smeltning af is ved O grader celcius og 1 atm gælder følgende:
ΔU = 6009 J/mol
ΔH = 6009 J/mol
For fordampning af vand ved 100 grader celcius og 1 atm gælder følgende:
ΔU = 8970 cal/mol
ΔH = 9710 cal/mol
1) Beregn ΔU og ΔH i J/g af vand ved 100 grader celcius og 1 atm.
2) Forklar hvorfor ΔU og ΔH er ens for smeltning, men ikke for fordampning af vand.
Svar #1
24. september 2016 af BechHohen88
Ang. 1)
Antag først, at;
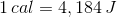
Du kan for fordampning af vand eksempelvis beregne 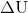 i joule ved;
i joule ved;
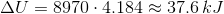
Samme proces gør du for 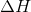 (med de 9710 kalorier).
(med de 9710 kalorier).
For at kunne beregne massen i gram skal du benytte relationen;
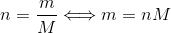
Hvor m er massen i gram, n stofmængen i mol mens M er molekylmassen i g/mol (slå den op).
Svar #2
24. september 2016 af kuerten15
1) 1 cal = 4,18 J
MW(H2O) = 18,02 g/mol
2) http://www.sciencepartners.info/?page_id=607
Svar #3
24. september 2016 af BechHohen88
Ang. 2)
Da opgaverne er fra "Opgavesamling til Cellens Kemiske Komponenter" formoder jeg, at du læser efter systemet af McMurry. I bogens kapitel om "Energy, Rates and Equilibrium" er størrelsen 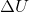 ikke eksplicit defineret, så det vil jeg gøre.
ikke eksplicit defineret, så det vil jeg gøre.
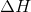 er ændringen i et systems termodynamiske energi ud fra systemets indre energi, tryk (p) og volumenændring (V) . Formelt er dette defineret ved;
er ændringen i et systems termodynamiske energi ud fra systemets indre energi, tryk (p) og volumenændring (V) . Formelt er dette defineret ved;
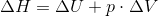
For at kunne definere 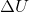 klart kan vi anvende Termodynamikkens Første Hovedsætning;
klart kan vi anvende Termodynamikkens Første Hovedsætning;
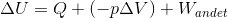
Hvor W er andre former for udført arbejde (irrelevant i vores tilfælde), mens Q er varmetilførslen. Grunden til at der er variation i denne størrelse ved fordampning og smeltning er, at der forekommer størr,e volumenændring, når vand går i gasfase. Ved smeltning er volumenændringen markant mindre, hvorfor den egentlgi er ligegyldig.
Skriv et svar til: Omregning af cal/mol til J/g
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.



