Kemi
pH for syre og baser
Jeg kunne virkelig godt bruge noget hjælp til den her opgave:
1) Beregn pH i 0,0100 M eddikesyre.
pH eddikkesyre=0,5 * (4,75 –log(0,0100)) = 3,38
b) Beregn derefter [H3O+], [CH3COO-] og [CH3COOH]. Det er den her opgave jeg har brug for hjælp til at forstå....jeg forstår de simpelthen ikke. Håber virkelig på der er nogle der kan hjælpe mig .
?Har også kigget på en tidligere tråd omkring opgaven, https://www.studieportalen.dk/forums/Thread.aspx?id=1394324
men er stadig ikke med på hvad der sker...og hvorfor. Er der en som kan hjælpe mig til at forstå det , ved måske at forklare det enkeltvis og på en lidt mere simpel måde
CH3COOH + H2O ↔ CH3COO- + H3O+
[H3O+] = 10-pH
[H3O+] = 10-3,38
ü [H3O+] = 0,000417 M
Forholdet mellem CH3COO- og H3O er 1:1, derfor gælder:
[H3O+] =[CH3COO-]
[CH3COO-] = 0,000417 M
[CH3COOH] =c[CH3COOH] -[CH3COO-]
[CH3COOH] = 0,0100 M– 0,000417 M = 0,00958 M
Svar #2
19. oktober 2016 af HFNU (Slettet)
Mange mange tak Mathon, formlen du skriver virker til at være let at bruge , problemet er nok at jeg ikke ved hvilke tal jeg skal bruge til at regne f.eks. H3O?+.
Kan du forklarer mig det også??
Svar #4
19. oktober 2016 af mathon
Når 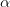 er dissocieringsgraden
er dissocieringsgraden
har man:
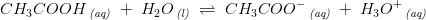
ligevægtskoncentrationer: 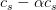
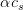
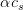
her bemærker du,
at
![\left [ CH_3COOH \right ]=c_s-\left [ H_3O^+ \right ]](https://media.studieportalen.dk/images/equations/tuA-WIZnDFbTZoALzTdqGg==.gif)
Svar #5
19. oktober 2016 af HFNU (Slettet)
CH?3COOH = c?s - H3?O+
Så resultaterne fra den tidligere opgave skal jeg trække oxonium?? Jeg tror slet ikke jeg er med
Svar #6
19. oktober 2016 af HFNU (Slettet)
Mange 1000 tak for hjælpen. Det var virkelig virkelig pænt af dig
Skriv et svar til: pH for syre og baser
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.










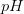 er defineret
er defineret![pH=-\log\left ( \left [ H_3O^+ \right ]/M \right )](https://media.studieportalen.dk/images/equations/mI55OuWik3MEPkM-JcXD3g==.gif)
![-pH=\log\left ( \left [ H_3O^+ \right ]/M \right )](https://media.studieportalen.dk/images/equations/VCMGrYB01k0exbUoZcXvSQ==.gif)
![10^{-pH}= \left [ H_3O^+ \right ]/M](https://media.studieportalen.dk/images/equations/EE4tf476rrT5y-LjHEd5vQ==.gif)
![\left [ H_3O^+ \right ]=10^{-pH}\; M](https://media.studieportalen.dk/images/equations/5ZMKC_kxat-DTLD0LNeR4w==.gif)
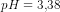 fra 1)
fra 1)![\left [ H_3O^+ \right ]=10^{-3{,}38}\; M](https://media.studieportalen.dk/images/equations/o3sdwst8mAS8XZWolPQjFg==.gif)