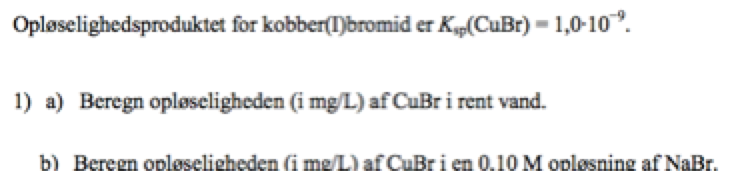Kemi
Kemi
Nogle, som blot kan hjælpe med opgave B. (Gerne med forklaringer.)
Svar #2
26. oktober 2016 af Skaljeglavedinelektier
a) x · x = 1,0 · 19-9. Omregningen til mg/L kan du finde ved at gange med molarmassen af CuBr og efterfølgende bare omregne fra g/L til mg/L.
b) Du får jo koncentrationen af Br-, da den er 0,10 M, hvis vi går ud fra, at der ikke befinder sig ret meget andet Br- i opløsningen. Du får:
[Cu+] · [Br-] = Ksp(CuBr) ⇔ [Cu+] · [0,1] = 1,0 · 10-9
Herefter kan du selv omregne til den ønskede enhed.
Svar #3
27. oktober 2016 af yuhgvbfr (Slettet)
Men har Na+ ingen inflydelse?
Hvorfor er ligevægtskonstanten ikke skrevet op som:
![K_S_p=\frac{[Cu^+][Br^-]}{[CuBr]}](https://media.studieportalen.dk/images/equations/lMS5cWTyiHs-Ue18abWDcw==.gif)
men som:
![K_S_p={[Cu^+][Br^-]}](https://media.studieportalen.dk/images/equations/AAqEk9CO2PAf8Xo0DTSubA==.gif)
Svar #4
27. oktober 2016 af yuhgvbfr (Slettet)
En anden ting jeg er i tvivl om er følgende:
[Cu+] · [Br-] = Ksp(CuBr) ⇔ [Cu+] · [0,1] = 1,0 · 10-9
Jeg går ud fra at man skal isolere 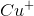 , men er det ikke opløseligheden af
, men er det ikke opløseligheden af 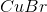 man skal finde og ikke af
man skal finde og ikke af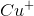 ? Jeg forstår nemlig ikke hvor man kan se bort fra
? Jeg forstår nemlig ikke hvor man kan se bort fra 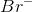
I øvrigt tusinde tak fordi du gerne vil hjælpe.
Svar #5
27. oktober 2016 af Skaljeglavedinelektier
CuBr er jo et fast stof.
[Cu+] vil være lig med [CuBr].
Du ser bort fra Br- fra den ekstra tilsatte Br-, og regner det som om, der bare er de 0,1 M.
Det er noget tid siden jeg har beregnet ligende opgaver, men det er sådan, jeg ville løse dem.
Svar #6
27. oktober 2016 af yuhgvbfr (Slettet)
#2 - Skaljeglavedinelektier
Vil du forklare mig, hvorfor du finder [Cu+] og ikke [CuBr] i forhold til opgave B? det vil være en meget stor hjælp.
Svar #8
27. oktober 2016 af yuhgvbfr (Slettet)
#7 - Skaljeglavedinelektier
Tak for svaret, men hvorfor det? Hvad sker der stå med Br-?
Svar #9
27. oktober 2016 af Skaljeglavedinelektier
Så vidt jeg forstår opgaven:
Du har jo Br- fra to "kilder". Fra CuBr og NaBr. Vi går ud fra at tilsætningen af CuBr ikke ændrer på, at koncentrationen af Br- i opløsningen er 0,1 M. Cu kommer kun fra CuBr.
Svar #10
27. oktober 2016 af yuhgvbfr (Slettet)
Tak fordi du vil hjælpe, men forstår stadig ikke helt, hvordan [Cu+] kan være lig med [CuBr]
Svar #11
28. oktober 2016 af mathon
Af
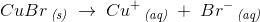
ser du, at for hvert 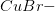 molekyle, der går i opløsning, dannes én
molekyle, der går i opløsning, dannes én 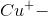 ion.
ion.
Svar #12
28. oktober 2016 af Skaljeglavedinelektier
Undskyld jeg ikke lige har fået svaret - det skyldes arbejde.
Jeg er ked af, at det ikke har fremgået tydeligt nok i #9 og #7, men mathons svar burde være klart nok.
Skriv et svar til: Kemi
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.