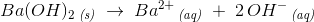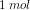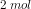Kemi
pH beregning hjælp!
07. december 2016 af
Niclas95 (Slettet)
-
Niveau: A-niveau
Der opløses 1,00 gram Ba(OH)2 i 100 mL vand.
Hvad bliver pH af opløsningen?
Svar #2
07. december 2016 af Niclas95 (Slettet)
Hvorfor skal man gange koncentrationen af Ba(OH)2 med 2 for at få koncentrationen af OH^-?
Skriv et svar til: pH beregning hjælp!
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




![[Ba(OH)_2]=\frac{\frac{10{,}0\;g}{171{,}34\;\tfrac{g}{mol}}}{L}=0{,}058\;M](https://media.studieportalen.dk/images/equations/Zbl-kGrKGHTpYvymakvq8Q==.gif)
![[OH^-]=2\cdot \left [ Ba(OH)_2 \right ]=2\cdot \left (0{,}058\;M \right )=0{,}118\;M](https://media.studieportalen.dk/images/equations/zR1H7Fk6BJ9hgwLvjlIr_w==.gif)
![pH=14+\log\left ( \left [ OH^- \right ] /M\right )=14+\left (\log0{,}118 \right )=13{,}1](https://media.studieportalen.dk/images/equations/Y5XZsjqdcEasXZOt9uQNJA==.gif)