Kemi
Beregning af pH
Hej jeg har følgende spørgsmål hvor jeg ikke rigtigt kan komme frem til det rigtige svar som er det der er hakket af:
På forhånd tak
Svar #1
10. december 2016 af Heptan
Den ene styrkekonstant er ca. 1000 gange større end den anden, så vi kan se bort fra den. De konstanter der er angivet er nemlig syrestyrkekonstanter, men natriumcarbonat er en base, så man skal bruge Ka(2). Det er en svag base, så man kan bruge formlen for monohydrone svage baser.
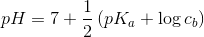 Monohydron svag base i rimelig koncentration
Monohydron svag base i rimelig koncentration
Svar #2
11. december 2016 af Ageless127 (Slettet)
Jeg har beregnet koncentrationen til at være 0.014 M, men det ser vist ikke ud til at være rigtigt, når jeg følger din formel. Først beregnede jeg hvor mange mol natriumcarbonat der var i opløsningen (0.0014 mol) og dernæst lavede jeg 100 ml om til 0.1 som gav en c=0.014 M.
Svar #4
12. december 2016 af Ageless127 (Slettet)
Altså jeg får stadig ikke en pH på 10.74 hvis jeg følger din formel:
Svar #5
12. december 2016 af Ageless127 (Slettet)
Okay nu kan jeg se hvad jeg har gjort forkert. Tak for det!
Skriv et svar til: Beregning af pH
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.



