Kemi
syre og baser og ph
11. januar 2017 af
messk (Slettet)
-
Niveau: B-niveau
Hej hvordan løser jeg følgende opgave er gået helt i stå
Vil gerne have udregninger hvor i forklarer grundigt hvad man gør. For er fuldstændig tabt på denne opgave desværre.
20 mL 0.120 M HNO_3 blandes med 80 mL. 2,5*10^-3 M HCL. Beregn blandings pH. (Beregn først stofmængden af H3O^+ i hver af de to opløsninger, hvorefter man kan beregne H3O^+ i blandingen da opløsningerne er ret fortyndede, kan man se bort fra volumenændringer og sætte balndingen til 10 mL
Please hjælp mig er gået helt i stå
Skriv et svar til: syre og baser og ph
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.










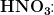 (når HNO3 betragtes som en stærk syre)
(når HNO3 betragtes som en stærk syre)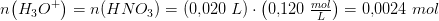
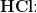
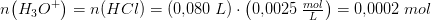 ?
?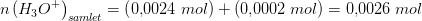
![\left [ H_3O^+ \right ]=\frac{0{,}0026\; mol}{0{,}100\;L}=0{,}026\; M](https://media.studieportalen.dk/images/equations/MHOqVaYlb1tkxckBoQMgqQ==.gif)
![pH=-\log\left ( \left [ H_3O^+\, \right ]/M \right )=-\log(0{,}026)=1{,}59](https://media.studieportalen.dk/images/equations/OYi2QI1ZIdyJJRhnO5weeA==.gif)