Kemi
Redoxreaktioner - HJÆLP
Hej folkens :)
Jeg har et stort problem med at forklare hvorfor følgende reaktioner er redoxreaktioner. Er der nogle der vil være søde og give mig en forklaring på hvordan man kan se at reaktionerne er redoxreaktioner?
1. 3CH_CH_2OH(aq) + 2Cr_2O_7(2-) (aq) + 16H+ (aq) --> 3CH3COOH(aq) + 4Cr^3+ (aq) + 11H_2O (l)
2. Cr_2O_7^2- (aq) + 14H+ (aq) --> 2Cr^3 + (aq) + 3I_2( aq) +7H_2O(l)
3. I_2(aq)+2S_2O_3(2-) (aq) --> 2I^- (aq) +S_4O_6(2-) (aq)
Svar #1
20. februar 2017 af Heptan
Der er tale om en redoxreaktion, hvis der sker en ændring i oxidationstrin. Du kan altså afgøre om en reaktion er en redoxreaktion ved at bestemme oxidationstrin for reaktanter og produkter, og se om et eller flere af dem ændrer sig.
Fx for reaktion 1, der har chromatomerne i den sammensatte ion dichromat, Cr2O72-, oxidationstrinnet +VI, men på højre side har chrom(III)ionen Cr3+ oxidationstrinnet +III, så chrom er altså reduceret med tre oxidationstrin. Med en reduktion følger altid en oxidation (derfor det kaldes reduktion-oxidation = redox), så hvis man også kan finde et atom der oxideres er det en redoxreaktion - carbon oxideres i dette tilfælde.
Svar #3
21. februar 2017 af 12345hey
Kan i muligvis give eksempler på alle tre reaktioner, så jeg får et indblik i hvordan man kan se det på reaktionerne? :D
Svar #7
21. februar 2017 af 12345hey
Men er nummer 2 den samme, som reaktionen jeg har skrevet op over? :)
Svar #8
21. februar 2017 af Heptan
#7
Nej, du har vist glemt at skrive iodid på venstre side. #4 er korrekt, men ikke afstemt.
Skriv et svar til: Redoxreaktioner - HJÆLP
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.



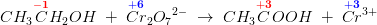

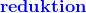
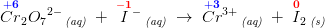
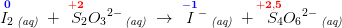
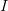 oxideres og
oxideres og 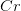 reduceres.
reduceres.