Kemi
Kemi reaktionshastighed
Der beregnes [BrO3-] til de aktuelle tidspunkter. Hertil skal anvendes startkoncentrationen af BrO3- og det afstemte reaktionsskema, der jo oplyser om ”forbruget” af BrO3- i forhold til dannet Br2.
BrO3- + Br- → Br3 + H2O
10,20,30,40,50,70,90,120,150
Startkoncentration af BrO3- 0,168 mol/L
Hvor beregnes disse? Mvh
Svar #5
26. februar 2017 af Heptan
Der mangler vist noget af opgaven. Brug dit integrerede hastighedsudtryk til at beregne [BrO3-].
Svar #6
26. februar 2017 af Mikkeldkdk
Hvad mener du med intergreret hastighedsudtryk? - Jeg mener da at hele opgaven er der.
Svar #7
26. februar 2017 af Heptan
Man kan ikke forudse hastighedsudtrykket ud fra et reaktionsskema, så du må finde ud af om det er en 0., 1. eller 2. ordensreaktion. Der findes et hastighedsudtryk til hver type reaktion.
Svar #8
26. februar 2017 af Mikkeldkdk
absorbans
Skriv et svar til: Kemi reaktionshastighed
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.






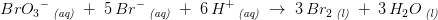
![[A]=-kt+[A]_0](https://media.studieportalen.dk/images/equations/11f4PXIuIQK9_hechF9T9g==.gif)