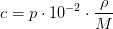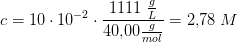Kemi
Ligevægte og koncentrationer
3c) Ammoniumionen er ligeledes en svag, monovalent syre, hvis korresponderende base erammoniak.Ligevægtskonstanten er K = 1,18 for reaktionen:
NH3 + B(OH)3 + H2O ? NH4+ + [B(OH)4]−
Beregn ammoniumionens syrestyrkekonstant.
3d) Ligevægten beskrevet i spørgsmål 3c) indtræder, når 3,092 g borsyre opløses i 200 ml 0,250 Mammoniakvand. Beregn koncentrationerne af NH3, B(OH)3, NH4
+ og [B(OH)4]− foruden pH i den
resulterende ligevægtsblanding, idet voluminet regnes for uændret. Molær masse/g·mol–1: B(OH)3: 61,83.
3e) En 10,00 % (masseprocent) vandig opløsning af natriumhydroxid har en densitet på 1,1110g/ml. Beregn opløsningens molære koncentration. Molær masse/g·mol–1: NaOH: 40,00.
Jeg har kigget alle 3 opgaver igennem -- og jeg er ikke helt sikker på, hvordan de skal løses...
Skriv et svar til: Ligevægte og koncentrationer
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.