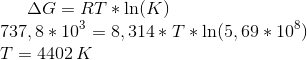Kemi
Temperatur for spontan reaktion
Hej alle sammen. Jeg håber nogen kan forklare, hvordan jeg skal bære mig ad med medenstående opgave. Har beregnet Gibbs energi og enthalpi ved 25 oC, men har fået af vide at reaktionen i praksis forløber ved en anden temperatur, hvor ligevægtskonstanten er K = 5,69*108 bar14.
Jeg skal bestemme temperaturen hvorved reaktionen vil forløbe spontant men kan ikke få det til at passe. Har prøvet at isolere temperaturen i den logaritmiske udgave af gibbs energi: ΔGstandard = R*T*lnK men får en negativ temperatur, der er langt lavere end det absolutte nulpunkt...
hvordan skal jeg løse denne opgave.
opgaven er vedhæftet

Skriv et svar til: Temperatur for spontan reaktion
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.