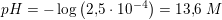Kemi
Beregning af pH
Hej!
Jeg har et spørgsmål verdrørende en kemiopgave, som jeg overhovedet ikke kan forstå. Jeg håber der er nogen af jer derude, der kan hjælpe med det? Det ville betyder meget!
Opgaven lyder således:
Beregn (H3o+), (oH-), OG pH I følgende oplysninger:
a) 0,1 mol/L NaoH
b) 0,5 mol/L HNO3
c) 0,2 mol/L Ca(oH)2
Svar #1
26. april 2017 af Smut1
Hej :)
Har desværre ikke lige nogen lommeregner, men jeg kan fortælle dig, hvordan du skal gøre.
pH = -log (H3O+)
Eks. HNO3 er en syre, og derfor er pH = -log (0,5)
NaOH derimod er en base, så førend du kan finde pH, skal du først have fundet H3O+
(H3O+)= 1,0*10-14M2/ (OH-)
1,0•10-14M2 er ionproduktet
(OH-) er for NaOH = 0,1 M
Skriv et svar til: Beregning af pH
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




![\small \left [OH^- \right ]=10^{-1}=0{,}1](https://media.studieportalen.dk/images/equations/0x4EPwBk-zqv8F2wcpaOYg==.gif)
![\small \left [H_3O^+ \right ]=\frac{10^{-14}\; M^2}{\left [ OH^- \right ]}=\frac{10^{-14}\; M^2}{10^{-1}\; M}=10^{-13}\; M](https://media.studieportalen.dk/images/equations/k_IVLURCydt2bf2yn0BfIQ==.gif)
![\small pH=14+\log\left ( \left [ OH^- \right ]/M \right )=14+\log\left ( 10^{-1} \right )=14-1=13](https://media.studieportalen.dk/images/equations/35yMkKcbrZh0GCJeH4p7bQ==.gif)
![\small \small \left [H_3O^+\right ]=0{,}5\; M](https://media.studieportalen.dk/images/equations/EpQTN408CSVDrVgyYXS8Ng==.gif)
![\small \small \left [OH^-\right ]=\frac{10^{-14}\; M^2}{0{,}5\; M}=2\cdot 10^{-14}\; M](https://media.studieportalen.dk/images/equations/47Na0lTPrLhfHYAQZElNQg==.gif)
![\small \small pH=-\log\left ( \left [ H_3O+ \right ]/M \right )=-\log(0{,}5)=0{,}3](https://media.studieportalen.dk/images/equations/pQ1J-4xrz3cxGQFZ4ulNzA==.gif)
![\small \left [ OH^- \right ]=2\cdot c(Ca(OH)_2)=2\cdot\left ( 0{,}2\; M \right )=0{,}4\; M](https://media.studieportalen.dk/images/equations/PyiZZUWx1SWIp8USH4jEDw==.gif)
![\small \left [ H_3O^+ \right ]=\frac{10^{-14}\; M^2}{0{,}4\; M}=2{,}5\cdot 10^{-14}\; M](https://media.studieportalen.dk/images/equations/LQC6FXVB3G1NCghmVtObRg==.gif)