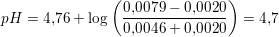Kemi
Beregning af pH
Jeg har en blanding eddikesyre-acetat buffer med pH på 5.00. Dets koncentration er 0.1M.
pka = 4.76.
Jeg skal finde den nye pH ved tilsætning af 6.30mL HCl 0.320M
Jeg finder først mine koncentrationen i bufferen med pufferligningen:
Jeg får det til at den indenholder 0.00793 mol base og 0.00457 mol syre.
Igen bruger jeg pufferligningen, og ligger nu 0.002mol syre til på syresiden i pufferligningen. Dette giver mig en pH på 4.84. Er dette korrekt?
Svar #2
04. maj 2017 af mathon
6.30 mL 0.320 M HCl ækvivalerer 0,0020 mol H3O+
1 L puffer indeholder
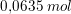 base
base
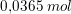 syre
syre
efter tilsætning af 0,0020 mol HCl:
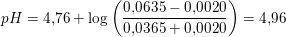
Skriv et svar til: Beregning af pH
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




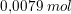 base
base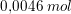 syre
syre