Kemi
Beregning af [OH]^- og [Ca^2+]
09. maj 2017 af
pokemonorm
-
Niveau: B-niveau
Hejsa kære studieportalsbrugere.
Jeg har lige et spørgsmål til en opgave, som lyder:
Der fremstilles en 0,012 M opløsning af calciumhydroxid, Ca(OH)2.
a. Beregn [OH^-] og [Ca^2+]
Hvordan gøre man dette?
MVH
Pokemonorm
Skriv et svar til: Beregning af [OH]^- og [Ca^2+]
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




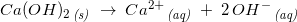
![\small \left [ Ca^{2+} \right ]=c\left (Ca(OH)_2 \right )=0{,}012\; M](https://media.studieportalen.dk/images/equations/hJTkbowuPGoBNWriPXgV0w==.gif)
![\small \left [OH^- \right ]=2\cdot c\left (Ca(OH)_2 \right )=2\cdot\left ( 0{,}012\; M \right )=0{,}024\; M](https://media.studieportalen.dk/images/equations/-sRJYuA8dmAssS3qNxC8rA==.gif)
![\small pH=14+\log\left ( \left [ OH^- \right ]/M \right )=14+\log(0{,}024)](https://media.studieportalen.dk/images/equations/OZE98HY5qgP5wlXhHXbKhQ==.gif)