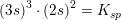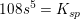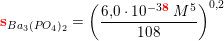Kemi
PH og opløselighed
Hej! Jeg har nogle spørgsmål til nogle PH opgaver. Er der ngole der kan give mig nogle hints på dem. Jeg kan sagtens finde formlerne for PH og opløselighedsprodukt, jeg ved bare ikke hvordan jeg skal bruge dem
Opgave 1:
0.400 M NH3 opløsning blandes med 0,200 M HCl opløsning. Idet pH i blandingen er 9,26, hvilket volumenforhold, vol(NH3):vol(HCl), er de to opløsninger da blevet blandet i?
Kb = 1.8 x 10^-5
Opgave 2:
Hvad er pH i en 0,50 M vandig opløsning af NaH2PO4 ?
Ka1 = 7.5 x 10^-3
Ka2 = 6.2 x 10^-8
Ka3 = 4.8 x 10^-13
Opgave 3:
Beregn opløseligheden ved 25 grader af BaSO4 der tilsættes en opløsning der i forvejen er 0,01 M med hensyn til Ba2+ . Opløselighedsproduktet for BaSO4 er 1.5 x 10^-9 ved 25 grader.
Opgave 4:
Opløselighedsproduktet for Ba3(PO4)2 er 6 x 10^-39 ved 25 grader.
Hvad er opløseligheden af saltet, såfremt der ses bort fra phosphat-ionens basiske egenskaber?
?
Svar #2
22. maj 2017 af mathon
Opgave 2:
Hvad er pH i en 0,50 M vandig opløsning af NaH2PO4 ?
Ka2 = 6.2 · 10-8 M ⇔ pKs = 7.20 dvs svag syre
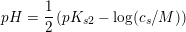
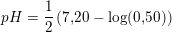
Svar #3
22. maj 2017 af mathon
Opgave 3:
Beregn opløseligheden ved 25 grader af BaSO4 der tilsættes en opløsning der i forvejen er 0,01 M med hensyn til Ba2+ . Opløselighedsproduktet for BaSO4 er 1.5 x 10-9 M2 ved 25 grader.
For en mættet opløsning:
![\small \left [ S{O_4}^{2-} \right ]=\frac{K_{sp}}{\left [ Ba^{2+} \right ]}](https://media.studieportalen.dk/images/equations/hBC7zlJNYB2mfBK-KT5zMQ==.gif)
![\small \left [ S{O_4}^{2-} \right ]=\frac{1{,}5\cdot 10^{-9}\; M^2}{10^{-2}\; M}=1{,}5\cdot 10^{-7}\; M](https://media.studieportalen.dk/images/equations/nLach_eAmGWuTGEoaIq71g==.gif)
her ses der i det følgende bort fra den minimale tilsætning af 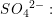
![\small c\left ( BaSO_4 \right )_{tilsat}=\left [S{O_4}^{2-} \right ]=1{,}5\cdot 10^{-7}\; M](https://media.studieportalen.dk/images/equations/976dbolCjIaJR2x2NQCaBA==.gif)
Skriv et svar til: PH og opløselighed
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.



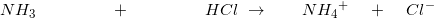
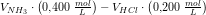
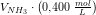
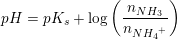
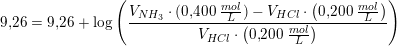
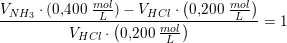
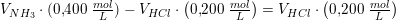
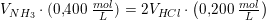
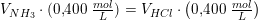
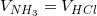
 af saltet, såfremt der ses bort fra phosphat-ionens basiske egenskaber?
af saltet, såfremt der ses bort fra phosphat-ionens basiske egenskaber?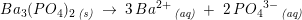
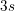
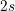
![\small \left [ Ba^{2+} \right ]^3\cdot \left [ S{O_4}^{2-} \right ]^2=K_{sp}](https://media.studieportalen.dk/images/equations/b99IALkF3ImhRMFBky9ohw==.gif)