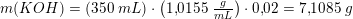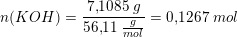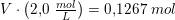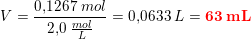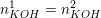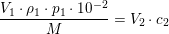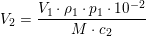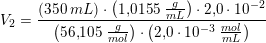Kemi
Hvad er fejlen ?
Hej
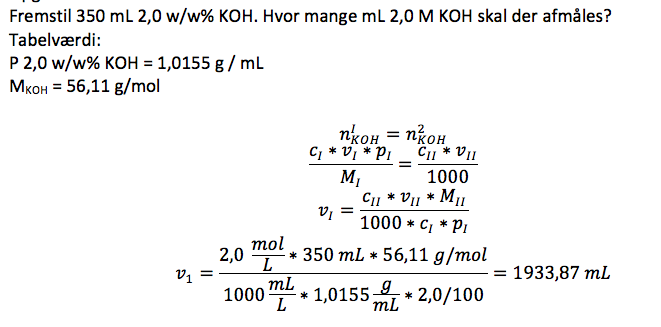
Opgaven står som et vedhæftet fil. Jeg har løst opgaven, men kan ikke forstå, hvorfor jeg bliver ved med at få det forkerte svar, er der en søde sjæl der kan kigge den igennem og se om der er noget glat i min beregning ?
Det rigtig resultat = 63 mL
På forhånd tak
Svar #1
10. juli 2017 af umolich
Først siger du ganske rigtig at du må skulle beregne molmængden, da den let kan findes for både produktet og den mængde der skal afmåles.
For produktet (350 ml 2,0 w/w% KOH) ved vi at 2,0 w/w% af de 350 ml (omregnet til gram) er KOH. Dvs to procent af
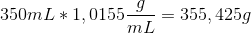
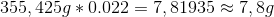
Det vil sige at du skal ende ud med 7,8g KOH i din opløsning - dette skal altså tilsættes som 2,0 M opløsning. For at finde ud af hvor meget 7,8 g er som 2,0 M opløsning, skal du omregne til mol, via molarmassen:
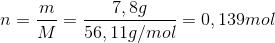
Og hvis du vil have 0,139 mol fra en 2,0 M opløsning, kan du finde volumenet således:
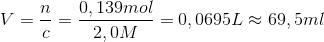
Jeg kan ikke komme nærmere det resultat du har givet, ud fra de givne tal.
Skriv et svar til: Hvad er fejlen ?
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.