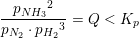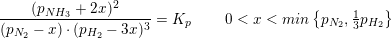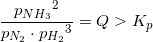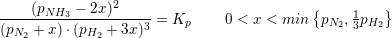Kemi
Partialtrykket for ammoniak
14. juli 2017 af
123451235123412345 (Slettet)
-
Niveau: A-niveau
Hej
Jeg skal beregne partialtrykket for ammoniak ved ligevægt i reaktionen
N2(g)+3H2(g) --) 2NH3
Kp=1,65*10^-4 bar^2.
Det samlede tryk i beholderen er 39,92bar
Skal jeg blot udregne ligningen:
1,65*10^-4 bar^2.= x^2/(39,92bar-x)*(39,92bar-x)^3 ?
Men bliver trykket for dinitrogenen og dihydrogenen så ikke identisk, hvilke ikke kan passe(mener jeg)?
Svar #3
15. juli 2017 af 123451235123412345 (Slettet)
Jeg kender derudover partialtrykkene for alle de indgående stoffet på et bestemt tidspunkt(ikke i ligevægt), samt temperaturen.
Skriv et svar til: Partialtrykket for ammoniak
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.