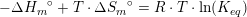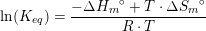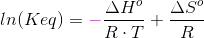Kemi
Reaktionsbrøk
Hej
Er der nogen der kan hjælpe med vedhæftede opgave? Gerne hele opgaven :-)
Svar #5
19. juli 2017 af Soeffi
#0. a) Kun gasformige stoffer indgår i reaktionsbrøken, når der der fast stof, flydende stof og gas. Gasserne indgår med deres partialtryk. Enheden for reaktionsbrøken bliver bar fordi partialtrykkene måles i bar, og fordi der står tryk i tredje i tælleren og tryk i anden i nævneren.
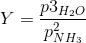
Svar #7
19. juli 2017 af Soeffi
#0. b)
ΔHo for reaktionen er:
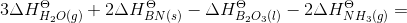
[3·(242,0) + 2·(-254,4) - (-1253,36) - 2·(-46,0)] kJ/mol =
[3·242,0 - 2·254,4 + 1253,36 + 2·46,0] kJ/mol =
[726,0 - 508,8 + 1253,36 + 92,0] kJ/mol = 1562,56 kJ/mol
ΔHo er positiv og reaktionen (mod højre) er dermed endoterm, dvs. den kræver energi-tilførsel for at forløbe.
Svar #8
19. juli 2017 af gymelev2
Svar #9
19. juli 2017 af Soeffi
#8
#5 Man får et vink om kun at tage de gasformige stoffer med ud fra oplysningen om, at reaktionsbrøken har enheden bar, som er en trykenhed.
#7 ΔHo for reaktionen er: [3·(-242,0) + 2·(-254,4) - (-1253,36) - 2·(-46,0)] kJ/mol = 110,56 kJ/mol
Du skal have ΔS: [3·ΔSo(H2O(g)) + 2·ΔSo(BN(s)) - ΔSo(B2O3(l)) - 2·ΔSo(NH3(g))] J/(mol·K) =
[3·188,8 + 2·14,8 - 78,45 - 2·198,8] J/(mol·K) = [566,4 + 29,6 - 78,45 - 397,6] J/(mol·K) =
119,95 J/(mol·K)
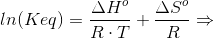
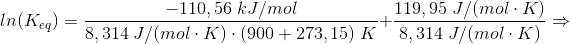
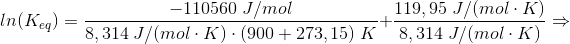
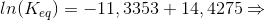
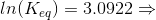
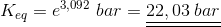
Svar #12
19. juli 2017 af Soeffi
#0. d) 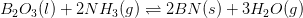
Partialtrykket af H2O(g) beregnes ud fra trykket af NH3(g). Fra start er trykket af NH3(g) lig med 1,00 bar. Det fremgår af reaktionsligningen, at partialtrykket af dannet H2O(g) er 1,5 gange trykket af omdannet NH3(g). Man kalder partialtrykket af omdannet NH3(g) for x. Ved ligevægt er partialtrykket af NH3(g) 1,00 bar - x og partialtrykket af H2O(2) er 1,5·x. Dette sættes ind i ligevægtsudtrykket, som skal give 22,0 bar ved 900 ºC:
22,0 bar = (1,5·x)3/(1,00 - x)2 ⇒ x = 0,7471 bar.
Dvs. partialtrykket af H2O(g) ved ligevægt ved 900 ºC er 1,5 · (0,7471 bar) = 1,1206 bar.
Massen af BN(s), som er dannet beregnes udfra antal mol NH3(g) dannet. I følge reaktionsligningen er antal mol dannet BN(s) er lig med antal mol omdannet NH3(g). Molmassen af BN er 25,0 g/mol. Antal omdannet mol NH3(g) kaldes n. Man får ved hjælp af idealgasloven:
P·V = n·R·T ⇒ n = P·V/(R·T) ⇒
n = (0,7471 bar)·(3 L)/(0,08314 bar·L/(mol·K)·(900+273,15)K) ⇒
n = (0,7471·3)/(0,08314·1173,15) mol = 0,022979 mol omdannet NH3(g) = antal mol dannet BN(s) ved ligevægt.
Massen af BN, der er dannet ved ligevægt ved 900 ºC er derfor: (0,022979 mol)·(25,0 g/mol) = 0,574 g
Svar #13
19. juli 2017 af gymelev2
#9#8
#5 Man får et vink om kun at tage de gasformige stoffer med ud fra oplysningen om, at reaktionsbrøken har enheden bar, som er en trykenhed.#7 ΔHo for reaktionen er: [3·(-242,0) + 2·(-254,4) - (-1253,36) - 2·(-46,0)] kJ/mol = 110,56 kJ/molDu skal have ΔS: [3·ΔSo(H2O(g)) + 2·ΔSo(BN(s)) - ΔSo(B2O3(l)) - 2·ΔSo(NH3(g))] J/(mol·K) =
[3·188,8 + 2·14,8 - 78,45 - 2·198,8] J/(mol·K) = [566,4 + 29,6 - 78,45 - 397,6] J/(mol·K) =
119,95 J/(mol·K)
Delta S er da oplyst i opgaven til 78,45 J/(mol*K), ikke sandt?
Svar #14
20. juli 2017 af Soeffi
#13Du skal have ΔS: [3·ΔSo(H2O(g)) + 2·ΔSo(BN(s)) - ΔSo(B2O3(l)) - 2·ΔSo(NH3(g))] J/(mol·K) = [3·188,8 + 2·14,8 - 78,45 - 2·198,8] J/(mol·K) = [566,4 + 29,6 - 78,45 - 397,6] J/(mol·K) = 119,95 J/(mol·K)
Delta S er da oplyst i opgaven til 78,45 J/(mol*K), ikke sandt?
Den indgår i beregningen som vist. Du skal finde reaktionens ΔSº; tabellen giver dannelsesentropien for en af reaktanterne.
Skriv et svar til: Reaktionsbrøk
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.



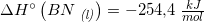
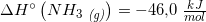
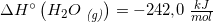
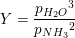
![\small \left [Y \right ] =\frac{bar^3}{bar^2}=bar](https://media.studieportalen.dk/images/equations/OEvkLB2NNxvWApXGN7Qm7Q==.gif)