Kemi
Hjælp til forståelse af redoxreaktion.
Hej! Jeg har nogle uopklarede spørgsmål, som jeg håber I kan hjælpe med.
Ved redoxtitreringen med Fe og KMnO4 (som jeg har vedhæftet nedenstående) har jeg svært ved at forstå, hvordan afgivelsen og optagelsen af elektroner helt præcist skal forstås. Skal det forstås således at Fe afgiver 5 elektroner, som Mn dernæst optages?
God aften!
Svar #1
08. august 2017 af JulieW99
Du skal forestille sig at redoxreaktioner er en fuldstændig elektronoverførsel, selvom den egentligt kun er delvist. Men ja - det skal forstås som at Mn stjæler Fe's elektroner. Fordi Mn har en højere elektronegativitet, vil den trække elektronerne over mod den.
Vh Julie
Svar #2
08. august 2017 af janhaa
Fe^2+ avgir ett e- => Fe^3+
MnO4^- tar opp 5 e- => Mn^2+
dvs tot 5 e- , se link under
Svar #3
08. august 2017 af Henry1505 (Slettet)
Aha tak for hurtigt svar! Kan det så passe at jern(III)ionerne sidder i et kompleks med vand?
Svar #4
08. august 2017 af janhaa
#3Aha tak for hurtigt svar! Kan det så passe at jern(III)ionerne sidder i et kompleks med vand?
ja
Svar #5
08. august 2017 af janhaa
#3Aha tak for hurtigt svar! Kan det så passe at jern(III)ionerne sidder i et kompleks med vand?
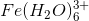
it's a weak acid, Ka << 1
Svar #6
08. august 2017 af JulieW99
Fidusen med redoxreaktioner er jo at lave ionbindinger dvs. komplet overførsel, selvom langt de fleste er kovalente. Så e- afgives faktisk ikke helt, de trækker bare mere over mod det stof der mest elektronegativt. Men fordi vi ikke gider de delvise positive og negative ladninger, tænker man det som ionbindinger og en hel overførsel af elektroner. Dermed har man fundet på redoxreaktioner for at forsimple det, og slippe for de delvise ladninger elektronerne ville få.
Vh Julie
Svar #7
08. august 2017 af Henry1505 (Slettet)
Thank you Janhaa,
I've tried to draw the situation, however, how is it possible for oxygen to have 4 bonds? I've attaced a photo. We know it has two with hydrogen, but how can it also have two spare for the bond with iron?
Skriv et svar til: Hjælp til forståelse af redoxreaktion.
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.








