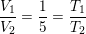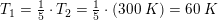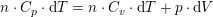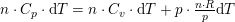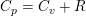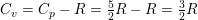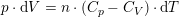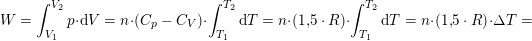Kemi
Bestemmelse af eksapansionsarbejde, w
19. august 2017 af
tayfun1 (Slettet)
-
Niveau: Universitet/Videregående
1,00 mol ideal gas med en molær varmekapacitet ved konstant tryk cp,m=(5/2)R ekspanderes i et varmeisoleret syste, hvor gassens tryk hele tiden er i mekanisk ligevægt med det ydre tryk, indtil gassens volumen er vokset med en faktor 5, og gassens temperatur efterfølgende måles til 300K. Bestem ekspansionsarbejdet, w ved denne proces.
Jeg har n= 1mol, V2=v1*5 og T2 =300K, men har ikke kunnet finde nogen måde at løse opgaven på uden flere oplysninger. Håber nogen kan hjælpe
Skriv et svar til: Bestemmelse af eksapansionsarbejde, w
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.









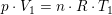
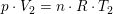 som ved division giver:
som ved division giver: