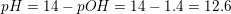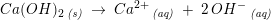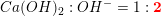Kemi
Kemiopgave
21. august 2017 af
Sinimini (Slettet)
-
Niveau: B-niveau
Kan nogen hjælpe med følgende opgave?
Ved forbrænding af fossile brændsler dannes der CO2. CO2 er en drivhusgas, og der kan derfor være god grund til at rense f.eks. skorstensrøg, før den udledes til atmosfæren.
Dette kan ske ved en reaktion med calciumydroxid, f.eks: CO2(g) + Ca(OH)2(aq) CaCO3(s) + H2O(l) (I) I et modelforsøg hældes 600 mL 0,0200 M Ca(OH)2 i et bægerglas.
a. Beregn pH for opløsningen.
Skriv et svar til: Kemiopgave
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


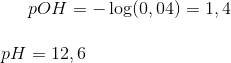
![\small \left [ OH^- \right ]=2\cdot \left [ Ca(OH)_2 \right ]=2\cdot \left ( 0{.}02\; M \right )=0{.}04\;M](https://media.studieportalen.dk/images/equations/rxAaIWbDeuCrZCKYnzy7RQ==.gif)
![\small pOH=-\log\left ( \left [ OH^- \right ]/M \right )=-\log\left (0{.}04 \right )=1{.}4](https://media.studieportalen.dk/images/equations/jD0q2VIQfS18ECvSv7LWiA==.gif)