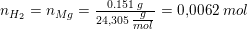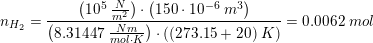Kemi
Find stofmængden af H2?
Hej alle.
Jeg har formlen: Mg (s) + 2 HCl (aq) --> MgCl2 (aq) + H2 (g)
Og følgende værdier:
Masse (Mg) = 0,151 g
Volumen (H2) = 150 mL
Temp: 20 grader
Tryk: 1,00 bar
Jeg skal først finde stofmængdeforholdet mellem magnesium og dihydrogen som jeg tror er 1:2.
Dernæst skal jeg finde stofmængden af Mg, hvor jeg bruger ligningen m/M (= 0,151 mol / 24,31 g/mol = 0,00621144 mol). Nu skal jeg finde stofmængden af dihydrogen, og jeg ved jeg skal benytte idealgasloven. Kan i hjælpe mig med dette punkt (gerne med hvordan det skal sættes op)? Uanset hvordan jeg vender og drejer det, går det ikke op, så noget må jeg gøre galt.
Hilsen Devuzhka.
Svar #1
22. august 2017 af Heptan
Stofmængdeforholdet findes som koefficienterne foran stofformlerne.
1 Mg (s) + 2 HCl (aq) --> MgCl2 (aq) + 1 H2 (g) Forhold 1:1
Idealgasloven:
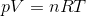
hvor p er trykket, V er volumen, n er stofmængden, R er gaskonstanten og T er temperaturen. Vi er interesserede i stofmængden n af dihydrogen, H2. Isolér n i ligningen:
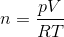
Svar #2
22. august 2017 af devuzhka (Slettet)
Tak for dit svar, Heptan!
Jeg bliver ved med at få svaret 6,16 når jeg sætter værdierne ind, men der er noget der ikke føles rigtigt. Er det muligt du kan prøve at sætte værdierne ind i formlen, så jeg kan se hvordan man gør?
Skriv et svar til: Find stofmængden af H2?
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.