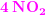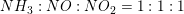Kemi
Hvilken formel
Trin 1: NH3 (g) + O2 (g) ? NO (g) + H2O (g) Afstem reaktionsskemaet og beregn hvor meget NO der dannes af 1 ton ammoniak. Derefter omdannes NO til nitrogendioxid ved endnu en forbrænding. Opskriv reaktionsskemaet og beregn hvor meget nitrogendioxid der kan fremstilles af den mængde NO der blev fremstillet i Trin 1 ?
4NH3 (g) + 5O2 (g) ? 4NO (g) +6 H2O (g)
Hvordan kommer jeg så frem til hvor meget NO2 der kan dannes af 1 ton ammoniak
Svar #1
22. september 2017 af Heptan
En forbrænding er en redoxreaktion med ilt, O2.
NO + O2 → NO2 (ikke afstemt)
Benyt mængdeberegninger til at svare på spørgsmålene. Brug formlen n = m/M hvor n er stofmængde, m er masse og M er molarmasse.
Svar #5
23. september 2017 af Meteora1 (Slettet)
Hej
Dit tal er rigtigt 58716.46 mol NO
så skal du videre
2 NO + O2 → 2 NO2
2 mol NO → 2 mol NO2
58716.46 mol NO → (2×58716.46)/2 mol NO2
gang de 58716,46 mol NO2 med molvægten for NO2 , så får du massen i gram , som så omregnes
til kg eller ton
Svar #7
23. september 2017 af Meteora1 (Slettet)
hej
Den er afstemt ( se linjen hvor O2 indgår)
Men O2 indgår ikke i beregningen
Svar #8
23. september 2017 af Meteora1 (Slettet)
#6
Molvægt for NO2 er 46.01 gram/mol
58716.46 mol NO2 vejer 58716.46 × 46.01 gram = 2701544.32 gram = 2701.54 kg = 2.701 ton
så ud af 1 ton NH3 dannes der 2.7 ton NO2
Svar #9
23. september 2017 af Cooljoan (Slettet)
Endelig reagere nitrogendioxid med vand og danner HNO3. Opskriv reaktionsskemaet og beregn hvor meget (ton) salpetersyre der kan fremstilles af 1 ton ammoniak
Svar #10
25. september 2017 af Meteora1 (Slettet)
#9
3 NO2 + H2O → 2 HNO3 + NO
3 mol NO2 → 2 mol HNO3
*58716.46 mol NO2 → (2×58716.46)/3 mol HNO3 = 39144.30
1 mol HNO3 vejer 63.01 gram
39144.30 mol HNO3 vejer 39144.30 × 63.01 gram = 2466482.76 gram
= 2466.48 kg = 2.466 ton = 2.5 ton HNO3
*58716.46 mol NO2 ( værdien taget fra #5 )
Skriv et svar til: Hvilken formel
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.





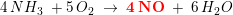 alle på gasform
alle på gasform