Molekyle
Hvad er et molekyle?
Et molekyle er kendetegnet ved, at det består af mindst to atomer, der er bundet til hinanden med kovalente bindinger. Det er vigtigt, at der er tale om netop kovalente bindinger, da atomer, der er bundet sammen af ionbindinger, i stedet kaldes et salt. En kovalent binding opnås, når atomernes orbitaler overlapper hinanden, og de derved deler to eller flere elektroner i mellem sig.
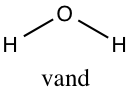
Et molekyle har ikke nødvendigvis de samme egenskaber som de grundstoffer, det består af. Faktisk har molekylerne som oftest radikalt andre egenskaber. Et godt eksempel på dette er, at vand består af to hydrogenatomer samt et oxygenatom. Disse grundstoffer findes normalt som dihydrogen (


Bindingstyper
Kovalente bindinger deles grundlæggende op i tre forskellige typer: enkel-, dobbelt, og tripelbindinger. Det er antallet af elektroner i bindingen, der adskiller typerne. Således består en enkelbinding af to elektroner, en dobbeltbinding af fire og en tripelbinding af seks elektroner. De to atomer, der danner bindingen, bidrager hver med halvdelen af de elektroner, der kræves i bindingen.
Organiske molekyler
Organiske molekyler er strengt taget defineret som molekyler, der indeholder kulstofatomer (C). Alligevel betragter man ikke molekyler som kuldioxid (

Antallet af bindinger i organiske molekyler
Ikke alle grundstoffer kan lave lige mange bindinger, og antallet af binding afhænger til en hvis grad af, hvor i det periodiske system grundstoffet er placeret. Endvidere afhænger det også af grundstoffets oxidationstal (et udtryk for, hvor mange af grundstoffets elektroner, der kan deltage i bindinger). En tommelfingerregel er dog, at halogener (17. hovedgruppe) og hydrogen laver én binding, oxygen (O) laver to, nitrogen (N) laver tre og carbon (C) laver fire bindinger. Bemærk, at dette gælder for neutrale molekyler. I tilfældet med ioner kan reglerne ikke bruges.
Eksempler på molekyler
Et af verdens mest kendte molekyler er vandmolekylet, 
Med denne information er det nu oplagt, at dihydrogen har følgende strukturformel.
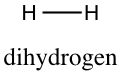
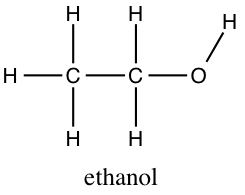
Der ses nu på det organiske ethanolmolekyle, der har molekylformlen (link) 
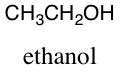
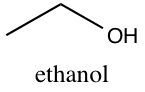
Molekylerne kan dog også være langt mere komplicerede, og et eksempel på dette er glukosemolekylet 
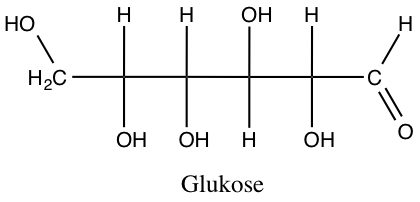
Ethanol er den alkohol, der anvendes i spiritus, mens glukose er den type sukker, kroppen anvender til at genere energi. Bemærk at molekyler, der består af de samme grundstoffer C, H og O, altså har vidt forskellige egenskaber.
Empirisk formel
Den empiriske formel for et molekyle angiver forholdet mellem de indgående grundstoffer i molekylet. For ethanol, 



Den empirisk formel bruges eksempelvis i forbindelse med identifikationsmetoder, hvor en forbrænding af et ukendt stof kan angive stoffets procentvise indhold af de forskellige atomer. På baggrund af disse oplysninger kan den empiriske formel beregnes, og man får en oplysning om, hvilket molekyle der er tale om.

