Strukturformel
En strukturformel adskiller sig fra molekylformlen og den empiriske formel ved at beskrive alle strukturelle detaljer om et molekyle. Det er altså både muligt at bestemme molekylformlen og den empiriske formel ud fra en strukturformel. Det gælder også, at strukturformlen for et molekyle er unik. Det vil sige, at der kun findes ét molekyle med netop den strukturformel. På grund af denne egenskab kaldes strukturformlen også for konstitutionsformlen, idet man kan se molekylets konstitution, altså dets sammensætning.
Helt konkret viser en strukturformel, hvordan alle atomerne i et molekyle er bundet sammen. Kovalente enkeltbindinger symboliseres med én streg, dobbeltbindinger med to osv. Derfor ser strukturformlen for ethanol således ud.
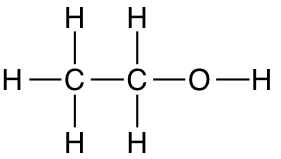
Ethanol
Indenfor organisk kemi vælger man dog ofte at benytte sig af forkortelser som 


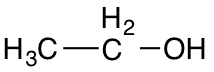
Ethanol
Man kan også reducere en strukturformel yderligere ved at bruge en stregformel. I en stregformel tegnes kulstofatomerne ikke, men symboliseres derimod ved et ’knæk’ i stregen. Kulstofatomets hydrogenatomer tegnes heller ikke på, da man antager, at et kulstofatom altid har 4 bindinger. Hvis kulstofatomet kun binder til ét andet atom, vides det automatisk, at det også binder til 3 hydrogenatomer. Binder kulstofatomet i stedet til 2 andre atomer, har det altså kun 2 hydrogenatomer osv. Stregformlen for ethanol ser derfor således ud.
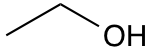
Ethanol
Et mere kompliceret eksempel på de tre forskellige måder at tegne strukturformler er acetylsalicylsyre. Det er tydeligt at se, at overskueligheden øges gennem de tre typer, selvom det kræver tilvænning at ’læse’ stregformlerne.
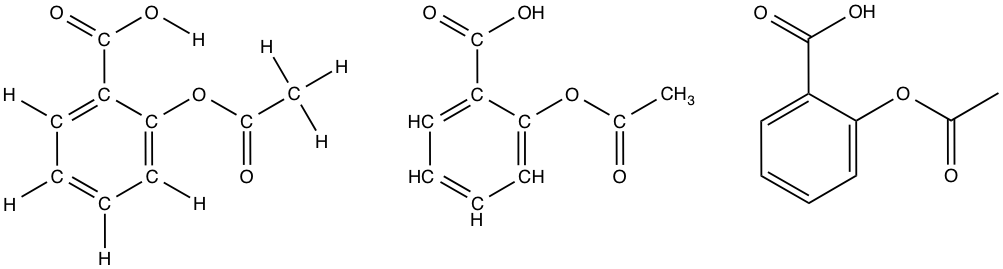
Acetylsalicylsyre
Hydrogenbindinger
Hydrogenbindinger er en type binding, der er svagere end de kovalente bindinger. For at forstå konceptet bør man kende til egenskaben elektronegativitet. Elektronegativiteten angiver i hvor høj grad, et atom trækker elektroner imod sig selv. Nogle af de mest elektronegative atomer er oxygenatomet, nitrogenatomet og fluoratomet. Når et af disse atomer er kovalent bundet til et hydrogenatom (der er langt mindre elektronegativt), opstår der en delvist negativ ladning på det elektronegative atom og en delvist positiv ladning på hydrogenatomet, fordi de negativt ladede elektroner trækkes væk herfra. Et eksempel på dette ses i ethanolmolekylet, hvor de delvise ladninger er markeret med et δ.
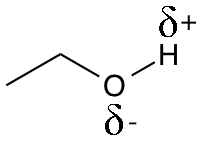
Positive og negative ladninger tiltrækkes af hinanden, og derfor dannes en hydrogenbinding, når et delvist positiv hydrogenatom tiltrækkes af et elektronegativt atom, som hydrogenatomet ikke er bundet kovalent til. I figuren herunder ses det, hvordan to ethanolmolekyler kan danne hydrogenbindinger til hinanden. Hydrogenbindinger symboliseres typisk med en stiplet linje.
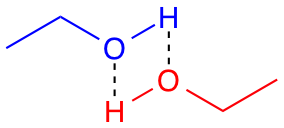
Hydrogenbindinger kan som nævnt kun dannes mellem hydrogenatomer og et meget elektronegativt atom. Derfor kan C-H-bindinger ikke bruges til hydrogenbindinger, idet kulstofatomet ikke er elektronegativt nok. Hydrogenbindinger er en blandt flere typer af intramolekylære bindinger. Disse karakteriseres som bindinger mellem to molekyler og altså ikke som interne bindinger i ét molekyle (som eksempelvis en kovalent binding).


