Kemi
Kemiske ligevægte !!
Hej.
Jeg forstår Le Chateliers princip.
Jeg forstår også kemisk ligevægt.
Men forstår ikke
Hvorfor en temperaturforøgelse vil tage reaktionen mod højre og en temperaturformindskelse vil tage den mod venstre?
Lad os tage et eksempel: N2O4 (harpun) 2NO2
Jeg vil gerne have det forklaret på molekyleniveau. Er det fordi, at to dinitrogentetraoxid forbruger energi, når det skal spaltes? Eller fordi nitrogendioxid afgiver energi, når det omdannes?
Svar #1
04. januar 2015 af Heptan
At der kræves en temperaturforøgelse når reaktionen forløber mod højre er det samme som at sige at reaktionen mod højre er endoterm.
Reaktionen mod venstre er så exoterm i dette tilfælde.
Du har helt ret i, at det er fordi dinitrogentetroxid forbruger energi når det spaltes. Når reaktionen forløber mod venstre, bliver der så afgivet varme.
Det skyldes at det kræver energi at bryde en kemisk binding. Det eneste der sker i reaktionen er, at N-N bindingen brydes, og elektronerne deles ligeligt mellem de to N-atomer. Når to NO2 molekyler reagerer med hinanden dannes der så en binding, og der frigives energi.

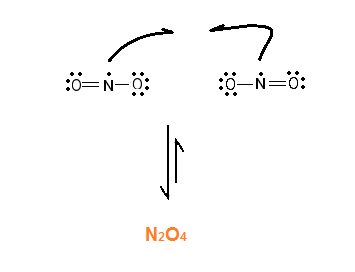
Grunden til at vi overhovedet har molekyler til at starte med, er at atomerne har mindre energi når de sammen, dvs. de får altså noget ud af at danne kemiske bindinger.
Skriv et svar til: Kemiske ligevægte !!
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.





