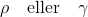Kemi
Side 2 - stamkurve
Svar #23
24. november 2014 af paaske1 (Slettet)
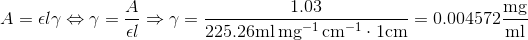
Er dette Lambert Beers lov? I såfald er γ så koncentrationen?
Svar #25
24. november 2014 af paaske1 (Slettet)
I dette trin: 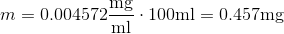
m = [koncentration]*V er det en special formel eller er det blot for at vinde masse af stoffet man gør dette?
Og er 0,457 mg massen af stoffet?
Svar #26
24. november 2014 af paaske1 (Slettet)
Men det er fordi at vi har lært at Lambert Beers lov lyder således:
A = €λ*l*[A]
, hvor [A] er kocentrationen. Kan man godt erstatte [A] med λ?
Svar #27
24. november 2014 af OliverGlue
#25 Når du ganger massen divideret med volumen med volumen får du jo massen af en given volumen.
#26 Du må også gerne bruge enhederne fra d), så får du stofmængdekoncentrationen, som du skal omskrive gange med molarmassen, for at få massen? Har du forstået d) fuldstændig?
Svar #28
24. november 2014 af paaske1 (Slettet)
Tror umiddelbart ikke at jeg har forstået d helt endnu så. Men vil jeg så samme eksitionskoefficient ved at finde benytte stofmængden istedet?
Svar #29
24. november 2014 af OliverGlue
I 13# lavede du regression med modellen
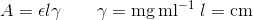
Hvis A skal være dimensionsløs (uden enheder), må ekstinktionskoefficienten have de modsatte enheder af gamma og længden, det giver
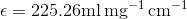
du bliver bedt om at finde den molare ekstinktionskoefficient, så først omregner vi til g / L
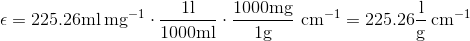
og divideres massen med molarmassen fåes stofmængden
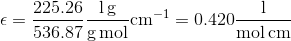
Så håber jeg det giver mening, at man blot vil benytte ekstinktionskoefficienten i e) med enhederne ml mg-1 cm-1 . Da man derved får massekoncentrationen og meget let kan omregne til massen ved at gange med volumen.
Svar #30
25. november 2014 af paaske1 (Slettet)
Mange gange tak! Det virkelig sødt at du gider at bruge din tid!
Skriv et svar til: stamkurve
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.