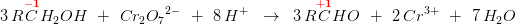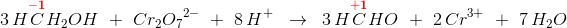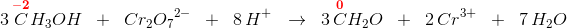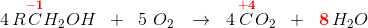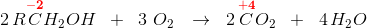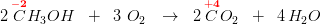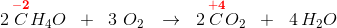Kemi
Oxidationstal
Oxidaionstallet af CH3OH?
Svar #2
06. januar 2015 af mathon
Anvendes den organiske kemis "gruppeoxidationstal" dvs afgrænset i forhold til resten af molekylet, som ikke deltager i redoxforløbet og derfor tildeles oxidationstallet 0 - da alt andet ville være for bøvlet,
har du
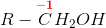 hvor her R = H
hvor her R = H
Anvendes den uorganiske kemis oxidationstal,
har du
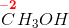
Uanset valg specifikt for 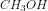 fås samme kemisk reaktionsforløb.
fås samme kemisk reaktionsforløb.
Det er så en temperamentssag om man vil medregne det ene "uvæsentlige" H's sædvanlige oxidationstal i forløbet eller ej.
I praksis bliver det den aktuelle kemilærers indstilling, der afgør valget.
Skriv et svar til: Oxidationstal
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.