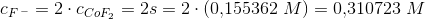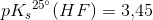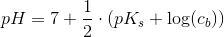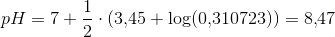Kemi
pH værdi i en mættet vandig opløsning
Hej.
Jeg sidder med en opgave som jeg har en del problemer med. Jeg ved ikke hvordan jeg skal komme igang med opgave b.
Svar #1
05. juni 2016 af SomethingDarkside
Vi får desuden at vide at CoF2 er tungtopløseligt med opløselighedsproduktet Ksp = 1,50*10^-2 M^3 ved 25 C
Svar #2
06. juni 2016 af mathon
a)
Kaldes den molære vandopløselighed ved 25°C for 
haves for en mættet opløsning:
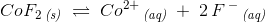
![\left [Co^{2+} \right ]\cdot \left [ F^{\, -} \right ]^2=K_o](https://media.studieportalen.dk/images/equations/aOcsr2KSj4xzY14r1lgIlg==.gif)
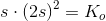
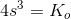
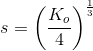
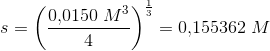
omregnet til masse pr volumen
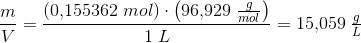
Svar #4
06. juni 2016 af SomethingDarkside
Mange tak for hjælpen. Ved du hvordan man laver opgave c? Jeg har prøvet med formlen for pH for en svag syre men får ikke det rigtige facit som er 3,44 * 10^-4 (jeg får 3.16*10^-4). Jeg får det "rigtige" resultat når jeg bruger formlen for en middelstærk syre dvs.
(H3O+)^2/c(a)-(H3O+) = Ka
Men jeg forstår simpelthen ikke hvorfor denne formel skal bruges frem for pH = 1/2(pKa - log(Ca))
Skriv et svar til: pH værdi i en mættet vandig opløsning
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.