Kemi
Ændring i Gibbs fri energi
Jeg har problemer med at udregne opgave b. Jeg får et facit på -58,0 og facit skal give -63.5. Jeg er fuldstændig i tvivl om hvilken formel jeg skal benytte til udregning.
Svar #1
13. juni 2016 af Toonwire
Hvad har du gjort, vis dine udregninger?
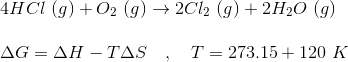
-----------------------------------------------------------------------------------------------------------
Svar #2
13. juni 2016 af SomethingDarkside
Mange tak så har jeg forstået det korrekt. Har simpelthen blandet rundt på de fortegn.
Skriv et svar til: Ændring i Gibbs fri energi
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.







