Kemi
Oxalatsalte
Hvorfor er oxalatsalte opløselige i stærk syre, men ikke svag?
Jeg ved at oxalatsalte er tungopløselige, men jeg ved ikke hvordan det skal forklares.
På forhånd tak.
Svar #1
21. oktober 2014 af Heptan
Det er fordi oxalat er en base.
Den kan protoneres af stærk syre, og danne den korresponderende syre oxalsyre (bemærk at oxalsyre er divalent)
Generelt uddriver en stærk syre en svagere syre af dens salt.
Oxalsyre er en middelstærk syre (pKa1 = 1,25 ... pKa2 = 4,14), så en svag syre vil altså ikke være i stand til at protonere oxalat.
Skriv et svar til: Oxalatsalte
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


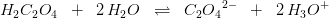 er stærkt forskudt mod højre
er stærkt forskudt mod højre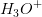 -koncentrationen meget, hvorved ligevægten forskydes mod venstre til ugunst for
-koncentrationen meget, hvorved ligevægten forskydes mod venstre til ugunst for 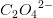 -koncentrationen, hvorved
-koncentrationen, hvorved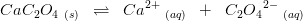 forskydes mod højre til gunst for
forskydes mod højre til gunst for