Kemi
Reaktionskinetik
Hej, er der nogen, som vil hjælpe med to vedhæftede opgaver?
Svar #1
18. november 2014 af OliverGlue
a)
Opskriv hastighedsudtrykkene
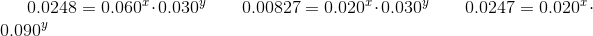
To udtryk med et reaktant med konstant koncentration divideres, og faktoren vil forsvinde
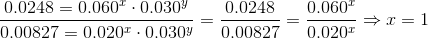
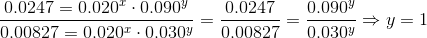
Det svære i ovenstående er matematikken, kemisk set skal du bare forstå at opstille hastighedsudtrykkerne og dividere dem og se faktoren med konstant koncentration forsvinder.
b)
Indsæt koncentrationer og hastighed fra tablen
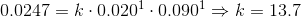
4)
Indsæt tal i
![v=k\cdot\mathrm{[NO_{2}]^{1}\cdot\mathrm{[O_{3}]^{1}}}](https://media.studieportalen.dk/images/equations/c07ksgF6ss2um8ftASd7Ow==.gif)
4a)
Fra ovenstående ligning kan du se, v er proportional med ændring i koncentrationer, da det er første ordens, dv.s. en faktor 2 på højre side giver også en faktor 2 på venstre side af ligheden. Reaktionshastigheden fordobles.
4b)
Samme argument som 4a), Reaktionshastigheden halveres.
Skriv et svar til: Reaktionskinetik
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.

