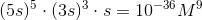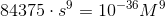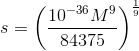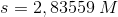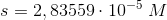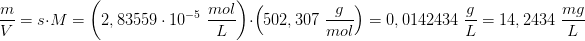Kemi
ligevægt
Hej, er der nogle, som gerne vil hjælpe mig med denne opgave?

Svar #2
19. november 2014 af paaske1 (Slettet)
Mange mange tusinde tak #1.
Vil du også gerne hjælpe mig med c'eren?
Svar #4
19. november 2014 af OliverGlue
a)
![K_{\mathrm{o}}=\mathrm{[Ca^{2+}]^{5}[PO_{4}^{3-}]^{3}[OH^{-}]}](https://media.studieportalen.dk/images/equations/8cGAugvcy-8CNiXlVJibpg==.gif)
Produkter i tælleren, reaktanter i næveren, de er opløftet i deres støkiometriske koefficienter. Bemærk faste stoffer og opløsningermideler ikke medtages.
b)
I forrige opgave skrev du en ligning, hvor ligevægtskonstanten er kendt, og den eneste ubekendte er koncentrationerne, når det faste stof bliver opløst, vil der dannes følgende ioner i 5*x calcium, 3*x fosfat og 1*x hydroxid, dv.s. ligningen
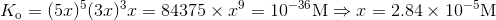
må gælde, som betyder der dannes 2.84 * 10^-5 M af hver x, vi husker der dannes 9*x ioner, så den aktuelle molære koncentration kunne beregnes. Dog bedes der om en masse per liter. Massen kan findes ved at gange med molarmassen af hydroxiapatite, som er ækvivalent med massen af de 9 ioner(massebevarelse)
2.84*10^-5 mol / L *502.31g / mol *1000mg/g=14.26mg/L
c)
Ud fra Le Chatliers princip kan du argumentere for at ligevægten forskydes mod højre, da der fjernes hydroxid, da det vil reagere med hydronium, som dannes af fosfatsyren i Coca Cola.
Svar #5
19. november 2014 af mathon
b) fortsat:
M(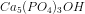 ) = M(Ca5P3O13H) = sum({5,3,13,1}*{40.078,30.974,15.999,1.008}) g/mol = 502,307 g/mol
) = M(Ca5P3O13H) = sum({5,3,13,1}*{40.078,30.974,15.999,1.008}) g/mol = 502,307 g/mol
opløseligheden af 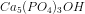
er:
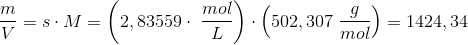
Svar #8
26. november 2014 af leasalamon (Slettet)
Hej, jeg er igang med en ligende opgave, som minder om a'eren, altså det med ligevægt. Jeg tænkter på at produktet som er Ca5(PO)3OH ser man bort fra da det er et fast stof, men forstår ikke hvorfor man ganger alle reaktanterne. Har det noget at gøre med at de er i væskefrom?
Skriv et svar til: ligevægt
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




![\left [ Ca^{2+} \right ]^5\cdot \left [ P{O_{4}}^{3-} \right ]^3\cdot \left [ OH^{-} \right ]=10^{-36}M^9](https://media.studieportalen.dk/images/equations/GKx5Ity0wbh_kmwgGVGVuQ==.gif)
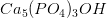 for s
for s