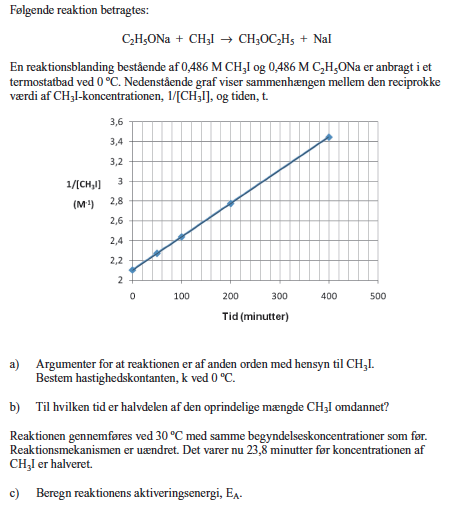
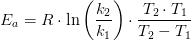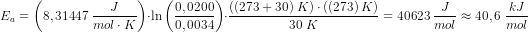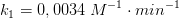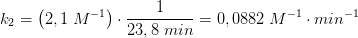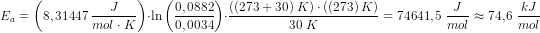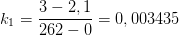Kemi
reaktionskinetik
Hej, jeg har med b'eren og især c'eren i denne opgave. Er der nogle, som gerne vil hjælpe mig med de to opgaver? :')
Svar #2
19. november 2014 af Sneharusha (Slettet)
Tak, men jeg ved ikke hvad hastighedskonstanten og begyndelseskoncentrationen er.
Svar #3
19. november 2014 af OliverGlue
#2 Du har fundet k i opgave a) og begyndelseskoncentrationen er 0.486M, det står i opgaven?
Svar #4
19. november 2014 af Sneharusha (Slettet)
Hov, det var jeg slet ikke opmærksom på, at man skulle finde. Tænkte på om man bare finder k ved at se hvad skæring med y-aksen er?
Svar #5
19. november 2014 af OliverGlue
#4 Din skæring med y-aksen er 1/begyndelseskoncentrationen
![\frac{1}{\mathrm{[A]}} = \frac{1}{\mathrm{[A]}_0} + k \cdot t](https://media.studieportalen.dk/images/equations/BoruMx2uf57UaYWm8XzeHA==.gif)
Du skal finde hældningen.
Svar #6
19. november 2014 af Sneharusha (Slettet)
Ved nul grader er tiden 0, så kan jeg ikke sige:
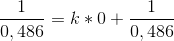
og isolere k eller er det helt forkert, da k vil give blive til 0.
Svar #7
19. november 2014 af OliverGlue
#6 Det er helt forkert, variablen i udtrykket er tid, t, der er ikke noget temperaturafhængigt i dette udtryk. Du skal bare finde hældningen på grafen, som er lig med din k.
Svar #9
19. november 2014 af OliverGlue
#8 Så skal du seriøst øve dig, hældningen er
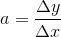
for en ret linje, kan du aflæse to punkter, og finde forskellen i deres x og y værdier, jeg vælger t=200 og 400
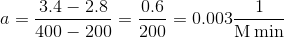
Svar #11
21. november 2014 af Sneharusha (Slettet)
Kan jeg spørge, hvor du får værdierne k2 = 0,0200 og k1 = 0,0034 fra?
Svar #12
21. november 2014 af OliverGlue
Benyt formlen for halveringstid, se #1, til at beregne k2. k1 skal stadig aflæses, #10 har blot aflæst mere præcist end #9.
Svar #13
21. november 2014 af Sneharusha (Slettet)
Åhh, jeg er så forvirret nu :( Vil I gerne svare på disse spørgsmål:
- Hvordan beregner man k2 ved hjælp af formlen for halveringstiden?
- Hvorfor kan man ikke beregne k1?
Svar #14
21. november 2014 af Sneharusha (Slettet)
Hvis man bergener sig frem til k2 vha. af halveringtidsformlen for man ikke 0,0200
Svar #16
22. november 2014 af Sneharusha (Slettet)
1) Hvor kommer 2,1 M-1 fra?
2) Kommer k1 fra hastighedskonstanten i delopgave b?
Svar #17
22. november 2014 af Sneharusha (Slettet)
OKay, jeg går ud fra at 2,1-1 M-1 er startkoncentration, men hvor fås 0,0034 M-1·min-1 fra?
Skriv et svar til: reaktionskinetik
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


![T_{\frac{1}{2}} = \frac{1}{k \cdot \ce{[A]}_0}](https://media.studieportalen.dk/images/equations/MQafUVllYv3q1txRkIxKOw==.gif)