Kemi
Hvordan skal man forklare masse, molarmasse og stofmængde
Stofmængde-den mængde, som man har af stoffet. F.eks. har 16 gram oxygen en stofmængde på 1 mol.
Atommasse/molarmasse:Den molare masse angiver, hvor meget et gram af stoffet vejer. F.eks. har oxygen en molarmasse på 16,00 gram, hvilket vil sige, at 1 gram oxygen vejer 16,00 gram.
Massen=vægten af det hele, altså hele molekylet.
Kan man forklare det på denne måde?
Tusind tak og god aften
Svar #1
25. november 2014 af OliverGlue
Stofmængde-den mængde, som man har af stoffet. F.eks. har 16 gram oxygen en stofmængde på 1 mol.
Atommasse/molarmasse:Den molare masse angiver, hvor meget et mol
gramaf stoffet vejer. F.eks. har oxygen en molarmasse på 16,00 gram, hvilket vil sige, at 1 molgramoxygen vejer 16,00 gram.Massen=vægten af det hele, altså hele molekylet
Stofmængde angiver mængden af et stof, og har enheden mol, en mol svarer til 6,02214×1023 formelenheder, som både dækker over atomer eller molekyler.
Molarmasse angiver massen per 1 mol af et stof, og har enheden gram / mol.
Massen angiver, analogt til alt andet, massen af et stof, og har enheden gram.
Der er følgende sammenhæng mellem de 3 størrelser
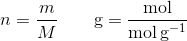
Skriv et svar til: Hvordan skal man forklare masse, molarmasse og stofmængde
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.






