Kemi
Indikator
Jeg har en base, hvis pH-værdi er 11,7, hvilke indikatorer kan benyttes?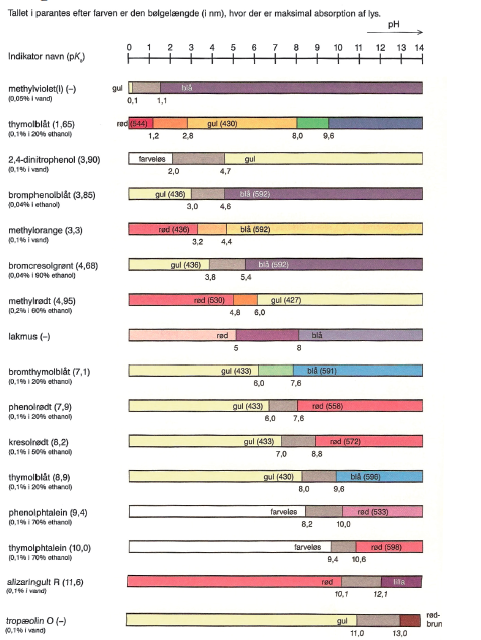
Svar #3
27. november 2014 af OliverGlue
pKs af den korresponderende syre er 3.4?
Så har opløsningen ikke en pH på 11.7.
Svar #5
27. november 2014 af OliverGlue
Okay
Omslagspunktet for en indikator sker, når mængden af korrespondrende base eller syre er tilstrækkelig til at absorbere en del af det synlige spektrum. Et estimat for dette er ved ækvivalente mængder syre og korresponderende base, det giver
![\small \mathrm{pH=p}K_{\mathrm{a}}+\log_{10}\left(\dfrac{[\mathrm{B]}}{[\mathrm{S]}}\right)\Rightarrow\mathrm{pH=p}K_{\mathrm{a}}+\log_{10}\left(\dfrac{1}{1}\right)=\mathrm{p}K_{\mathrm{a}}](https://media.studieportalen.dk/images/equations/PDl3AZ6KoGrHiyZwcYoBpQ==.gif)
som siger, når pH er lig med pKa (for indikatoren) vil omslagspunktet cirka være nået - farveskiftet. Det behøves ikke være netop ved en given pH, da pH altid springer 2-3 i værdi, når ækvivalenspunktet er noget pg.a. den logaritmiske skala. Så der ønskes blot en indikator med pKa ~ pH i ækvivalenspunktet.
Du kan starte med at finde molariteten af din opløsningen, da du kender styrkekonstanten og pH. Det giver ~0.1M. Dernæst kan du finde pH ved ækvivalenspunktet, du ved al basen må være omdannet til sin korresponderende syre dér med en pKa på 10.6, og pH kan findes til 5.8. Det betyder, methylrødt vil være en oplagt indikator, da den har en pKa på 4.95.
Du kan også blot kigge i tablen, og se omslagspunktet for methtylrødt er i intervallet 4.8 til 6 i pH, og du ved pH i dit ækvivalenspunkt er 5.8.
Svar #6
29. november 2014 af Sneharusha (Slettet)
Du kan også blot kigge i tablen, og se omslagspunktet for methtylrødt er i intervallet 4.8 til 6 i pH, og du ved pH i dit ækvivalenspunkt er 5.8.
Hvordan ved jeg at pH i mit ækvivalenspunkt er 5,8?
Svar #7
29. november 2014 af OliverGlue
Svar #8
29. november 2014 af Sneharusha (Slettet)
#7 Det forstår jeg desværre intet af.
Mit spørgsmål er blot, hvilke indikatorer fra tabelen jeg kan vælge, hvis jeg kun kender pH-værdien som er 11,7.
Skriv et svar til: Indikator
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.

