Kemi
syre/base
Hej
Jeg sidder fast i en kemi opgave som jeg ikke helt ved, hvordan jeg skal løse. Jeg har kigget i min bog og set på formlerne som jeg tror jeg skal bruge, men er stadig usikker på hvordan.
spøgrsmålet lyder:
En opløsning ad HCl i vand har pH-værdien 2,3. Hvad bliver pH værdien hvis man tilsætter 75 ml rent vand til 25 ml af denne opløsning?
Svar #1
26. december 2014 af OliverGlue
Du kan finde koncentrationen med pH = -log10(c) <=> c = 10^-pH
c = 10^-2.3 = 0.0050 M
Fortydningsformlen cfør Vfør = cefter Vefter kan bruges til at finde koncentration efter fortydning, det giver
0.005 * 25 = c * 100 <=> c = 0.00125 M
Endeligt kan pH findes
pH = -log10(0.125) = 2.9
Svar #2
26. december 2014 af Naaaanai (Slettet)
Tusind tak, men den der fortyndingsformlen kan jeg slet ikke finde i min bog og det har vi heller ikke lært om.
er der andre måder at beregne det på eller er det den eneste udvej?
-Kan man beregne stofmængden da vi kender koncentrationen?
Svar #3
26. december 2014 af Naaaanai (Slettet)
hvis man nu beregner stofmægden, kan man så bruge denne her formel
pH=PKs+log(nB/nS) ?
Svar #4
26. december 2014 af OliverGlue
#1 Jeg skrev forkert i sidste linje, det skal være pH = -log10(0.00125) = 2.9
#2 Ja du kan beregne stofmængden, du kender jo volumen og du kender koncentration ud fra pH, det giver
n = c * V
nfør = 0.005 M * 25 mL = 0.125 mmol
som også må være lig med nefter, hvoraf fortydningsformlen kommer
0.125 mmol = cefter * 100 mL <=> cefter = 0.00125 M
#3 Nej
Svar #5
26. december 2014 af Heptan
#2 Nu har du lært den, så nu kan du bruge den. Du kan overbevise dig selv om, at den må være sand, da den her formel står i bogen:
c = n/V n = cV
For de to systemer "før" og "efter" må der altså gælde, at
n(før) = c(før) * V(før) n(efter) = c(efter) * V(efter)
Du nævner selv, at stofmængden må være konstant. Altså kan vi have at der for de to systemer må gælde følgende: n(før) = n(efter)
og dermed
c(før) * V(før) = c(efter) * V(efter)
Svar #6
26. december 2014 af Heptan
Istedet for at bruge fortyndingsloven, kan du observere, at opløsningen bliver fortyndet med en faktor 4. pH ændrer sig derfor med log(4) = 0,6
Dvs. pH bliver 2,3 + 0,6 = 2,9
Svar #7
27. december 2014 af Naaaanai (Slettet)
Nu er jeg med!
Tusind tak for jeres forklaringer og jeres tid!
men fx her:
n = c * V
nfør = 0.005 M * 25 mL = 0.125 mmol
0.125 mmol = cefter * 100 mL <=> cefter = 0.00125 M
n=cefter·0,1L (som kommer fra de 75 mL & 25 mL tilsammen ik?)
når man har fundet cefter, så finder man pH.
også har du brugt denne formel til at beregne pH ik?
pH=-log(cs/M)
Skriv et svar til: syre/base
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.



![\small \small c_{HCl}=\left [H_3O^+ \right ]=10^{-pH}=10^{-2,3}=0,005012\; M](https://media.studieportalen.dk/images/equations/FewBIdP_8Q-NQqYYa9tjaA==.gif)
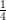
![\small \left [ H_3O^+ \right ]_{fort}=\frac{1}{4}\cdot (0,005012\; M)=1,25297\cdot 10^{-4}\; M](https://media.studieportalen.dk/images/equations/ijUpmctbeWIw-DISAeVApQ==.gif)