Kemi
Ligevægtskonstant
Hej, er der nogle, som gerne vil hjælpe mig med opgave d i nedestående opgave? :)

Svar #1
28. december 2014 af Heptan
Du skal beregne enthalpitilvæksten, og derefter bruge Van't hoffs ligning til at beregne ligevægtskonstanten ved den pågældende temperatur. Eller det er egentligt ikke Van't hoffs ligning, men det er den her:
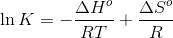
Svar #2
28. december 2014 af LubDub
c.
ΔH0 = H0(produkter) - H0(reaktanter)
= - 1180,9 kJ /mol - (2•(- 80 kJ / mol) - 814 kJ / mol) = - 205,3 kJ / mol
Da
ΔH0 < 0 er det en exoterm reaktion
Svar #4
28. december 2014 af LubDub
når det er skrevet som i #1, så er det underforstået, at der er tale om ændring i hhv. den molare standardentalpi og molare standardentropi :)
Svar #5
28. december 2014 af LeonhardEuler
Det er muligt. Dog skrev #1 kun "enthalpitilvæksten", hvor der intet blev nævnt om molare enthalpitilvækst, hvorfor det kunne give anledning til misforståelser. :-)
Skriv et svar til: Ligevægtskonstant
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


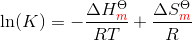 Van't Hoffs ligning
Van't Hoffs ligning