Kemi
Vands ligevægtslov
Ligevægtsloven for vand er:
[H3O+] * [OH-] = Kv
Hvorfor ser det sådan ud?
Umiddelbart tænker jeg på heterogene ligevægt, da man bruger samme princip.
Svar #1
14. maj 2015 af renzir
Eller måske er det fordi man sætter vands molbræk = 1 så derfor kan man se bort fra den?
Svar #2
14. maj 2015 af LeonhardEuler
Det er korrekt. Du har da vands egendissociation
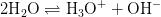
Ligevægtsbrøken er da
![\textup{K}_v=\frac{ \left [\textup{H}_3\textup{O}^+ \right ] \cdot \left [\textup{OH}^- \right ]}{x(\textup{H}_2\textup{O})^2}\approx \left [\textup{H}_3\textup{O}^+ \right ] \cdot \left [\textup{OH}^- \right ]](https://media.studieportalen.dk/images/equations/6CaCE_dZVoi6iN05hgpNxw==.gif)
for x(H2O) ≈ 1
Skriv et svar til: Vands ligevægtslov
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.







