Kemi
Molaritet og koncentration?
Hej
Er molaritet og koncentration det samme? Hvorfor bruge to forskellige ord så?
Og begge har samme enhed?
Svar #1
05. juli 2015 af Arccossintan (Slettet)
Ja, det er nøjagtig det samme. Enheden for molær betegnes med et lille (stort) M for ikke at skabe forveksling med molarmassen, der også betegnes M, men blot med et større (stort) M. Det kan være forvirrende indtil, at man får styr på det, og det er beklageligt, at det er sådan - mange kemikere finder det også forkert. Enheden molær (M), der har symbolet c i nedenstående formel, er i øvrigt afledt af:
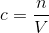
Da stofmængden n angives i enheden mol og volumet V angives i liter, er enheden for stofmængdekoncentrationen (molær) derfor mol/L. Molær er således et udtryk for, hvor stor en stofmængde en opløsning indeholder pr. liter.
Svar #3
05. juli 2015 af Arccossintan (Slettet)
For lige at skabe total klarhed:
Molaritet og stofmængdekoncentration er det samme og deler derfor naturligvis enhed. Og hvorfor har én værdi flere forskellige betegnelser? Sådan er det ofte, og det skal man vist ikke forholde sig så meget til.
Jeg fik egentlig svaret på, hvorfor stofmængdekoncentration og molarmasse har samme symbol, men dette er en anden sag - men det forholder sig, som jeg forklarede i #1. Molaritet og molarmasse er altså ikke det samme. Jeg er ked af, hvis jeg har forvirret dig, men hellere en forklaring for meget, end at jeg vildleder dig.
Svar #4
05. juli 2015 af Hijsa
Svar #5
05. juli 2015 af mathon
Koncentrationen af et stof i en opløsning (en homogen blanding) kan angives på mange forskellige måder.
Hvis koncentrationen angives i % (procent), kan det være tvivlsomt, om der menes vægt-% (det vil sige antal g opløst stof i 100 g opløsning) eller vol-% (det vil sige antal mL opløst stof i 100 mL opløsning), selv om %-angivelser i flydende opløsninger hyppigst er vægt-% og i gasblnadinger hyppigst er vol-%. I mange tilfælde kan der dog for de flydende opløsninger ikke være nogen tvivl: Angivelsen 5 % NaCl må betyde 5 vægt-%, da der ingen mening ville være i at bestemme volumen af det faste NaCl, inden man opløser det.
Molariteten 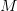 er der redegjort for i #1.
er der redegjort for i #1.
Molalitet 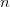 betyder antal mol opløst stof i pr kg opløsningsmiddel (er ikke temperaturafhængig som det strengt taget er tilfældet med koncentrationsangivelsen
betyder antal mol opløst stof i pr kg opløsningsmiddel (er ikke temperaturafhængig som det strengt taget er tilfældet med koncentrationsangivelsen 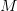 ).
).
Molbrøk betyder antal mol af et opløst stof i forhold til det totale antal mol blanding.
Oversigt:
I flydende og gasformige opløsninger anvendes:

I flydende opløsninger anvendes desuden:

Svar #6
05. juli 2015 af Hijsa
#5
Kan du forklare mig hvad normalitet er? Og hvordan denne udregnes?
Svar #7
05. juli 2015 af mathon
normalitet 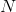 :
:
antal gramækvivalenter opløst stof i 1 L opløsning.
gramækvivalent 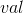 :
:
så mange gram af et stof, som ækvivalentvægten angiver.
ækvivalentvægt = ækvivalentets masse i atommasseenheder.
ækvivalent af et stof er kun defineret i tilknytning til en kemisk proces. Sker der ingen ændring i oxt. er et ækvivalent af et stof = den mængde af stoffet, der kan forene sig med eller erstatte et monovalent atom.
Sker der en ændring i oxt., er et ækvivalent af et stof den mængde af stoffet, der stiger eller falder én i oxt.
Skriv et svar til: Molaritet og koncentration?
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.



